資源簡介
資源簡介
(共11張PPT)
離
子
反
應
第4課時
離子檢驗與離子推斷
化學必修一 第一章 化學物質及其變化
離子反應廣泛應用于化學研究、工業生產、醫療診斷、食品檢驗、環境保護等方面。
利用離子反應可以檢驗某種(或某些)離子是否存在。
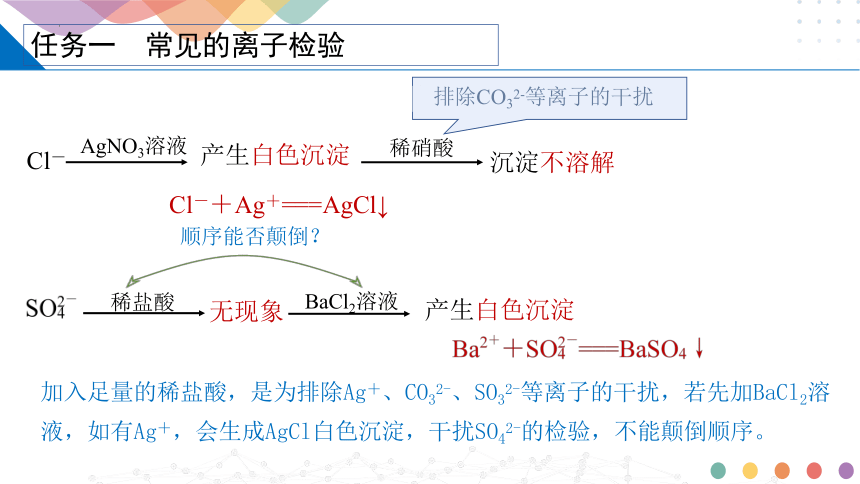
任務一 常見的離子檢驗
CaCl2溶液
產生白色沉淀
稀鹽酸
沉淀溶解,產生無色無味氣體,氣體能使澄清石灰水變渾濁
CaCO3+2H+===Ca2++CO2↑+H2O
方法:往溶液中滴加某試劑發生離子反應,根據特殊的現象(特殊顏色、沉淀、氣體等),來證明某離子的存在。
注意:排除其他離子的干擾。
答題模板:取樣 試劑 現象 結論
排除HCO3- 、HSO3- 、SO32- 干擾
任務一 常見的離子檢驗
Cl-
AgNO3溶液
稀硝酸
沉淀不溶解
Cl-+Ag+===AgCl↓
加入稀HNO3的目的是什么?
產生白色沉淀
排除CO32-等離子的干擾
產生白色沉淀
稀鹽酸
無現象
BaCl2溶液
順序能否顛倒?
加入足量的稀鹽酸,是為排除Ag+、CO32-、SO32-等離子的干擾,若先加BaCl2溶液,如有Ag+,會生成AgCl白色沉淀,干擾SO42-的檢驗,不能顛倒順序。
隨堂檢測
下列對離子檢驗的實驗過程的評價正確的是
A. 向溶液中加鹽酸酸化的BaCl2溶液,生成白色沉淀,則溶液中一定有SO42-
B. 向溶液中加BaCl2溶液,再加鹽酸,生成白色沉淀,則該溶液中一定有SO42-
C. 向溶液中加稀硫酸,產生氣泡,則該溶液中一定有CO32-
D. 向溶液中先加硝酸酸化,再加AgNO3溶液,生成白色沉淀,則該溶液中
一定有Cl-
D
任務二 離子推斷
某無色透明溶液中可能含有下列離子中的一種或幾種:Na+、Mg2+、Cu2+、OH-、Cl-、CO32-、NO3-。現進行如下實驗:
①用紅色石蕊試紙檢驗,試紙變藍色。
②另取少量溶液逐滴滴加鹽酸至過量,無氣體放出,再加入BaCl2溶液后,沒有沉淀生成。
③另取少量溶液用硝酸酸化后,加入AgNO3溶液有白色沉淀生成。
根據上述實驗推斷:原溶液中肯定有______________,肯定沒有______________,不能肯定存在________。
【答案】 OH-、Na+、Cl-; Mg2+、Cu2+、CO32- ; NO3-
任務二 離子推斷
肯定性原則
根據實驗現象推出溶液中肯定存在或肯定不存在的離子
記住幾種常見的有色離子:Fe2+、Fe3+、Cu2+、MnO4-、CrO42-、Cr2O72-
互斥性原則
在肯定某些離子存在的同時,結合離子共存規律,否定一些離子的存在
注意題目中的隱含條件:如酸、堿性、指示劑顏色變化、與鋁反應產生H2、水的電離情況等
電中性原則
溶液呈電中性,溶液中有陽離子,必有陰離子,且溶液中陽離子所帶正電荷總數與陰離子所帶負電荷總數相等
這一原則可幫助我們確定一些隱含的離子
進出性原則
通常在實驗過程中用,指實驗過程中反應生成的離子或引入的離子對后續實驗的干擾。
四項基本原則
隨堂檢測
某溶液的溶質可能由下列離子組成:Cl-、SO42-、CO32- 、H+、Ba2+、Na+,某同學進行如下實驗探究其組成:
①向溶液中加入過量的BaCl2溶液,有白色沉淀產生,過濾;
②向①中濾液中加入AgNO3溶液,有白色沉淀產生;
③將①中的沉淀加入稀鹽酸中,沉淀部分消失,有氣體產生
依據以上實驗可以推斷,原溶液中一定含有______________________;一定沒有________________;可能含有________。
H+、Ba2+
Cl-
任務三 離子反應的應用-物質的分離提純
以粗鹽(雜質為Na2SO4、MgCl2、CaCl2)提純為例
粗食鹽水
Na+、Cl-、Mg2+、SO42-、Ca2+
要保留的離子
雜質離子
Na+、Cl-
Mg2+
SO42-
Ca2+
過量
NaOH溶液
過量
BaCl2溶液
過量
Na2CO3溶液
Mg(OH)2↓
BaSO4↓
CaCO3↓
過濾
CO32-、OH-
先
后
稀鹽酸
物 質 的 分 離 提 純
BaCO3↓
最后
任務三 離子反應的應用-物質的分離提純
為除去粗鹽中的Ca2+ 、Mg2+ 、SO42-和泥沙,可將粗鹽溶于水,再進行下列操作:(1)過濾 (2)加過量的氫氧化鈉溶液(3)加適量的鹽酸 (4)加過量的碳酸鈉溶液(5)加過量的氯化鋇溶液。
不正確的操作順序是
A.(1)(5)(2)(4)(1)(3)
B.(1)(2)(5)(4)(1)(3)
C.(1)(5)(4)(2)(1)(3)
D.(1)(4)(5)(2)(1)(3)
D
物質的分離和提純的“三必須”和“四原則”
(1)三必須
①除雜試劑必須稍過量。
②過量試劑必須除盡,且容易除去。
③除雜途徑選最佳,有多種雜質時除雜順序必須合理。
(2)四原則不增、不減、易分離、易復原
隨堂檢測
某工業廢水中存在大量的Na+、Cl-、Cu2+、S,欲除去其中的Cu2+、S,設計工藝流程如圖所示:
(1)試劑a溶液為 ,試劑b溶液為 。
BaCl2溶液
Na2CO3溶液
(2)操作X為 ,試劑a、b (填“能”或“不能”)對調順序。
過濾
不能
(3)如何檢驗廢水中的SO42-已除盡: 。
取上層清液少許于試管中,加入適量BaCl2溶液,若無明顯現象則SO42-已除盡。
展開更多......
收起↑
 資源預覽
資源預覽