資源簡介
資源簡介
(共14張PPT)
第3課時 物質(zhì)的轉(zhuǎn)化
化學(xué)必修一 第一章 物質(zhì)及其變化
第一節(jié) 物質(zhì)的分類及轉(zhuǎn)化(3課時)
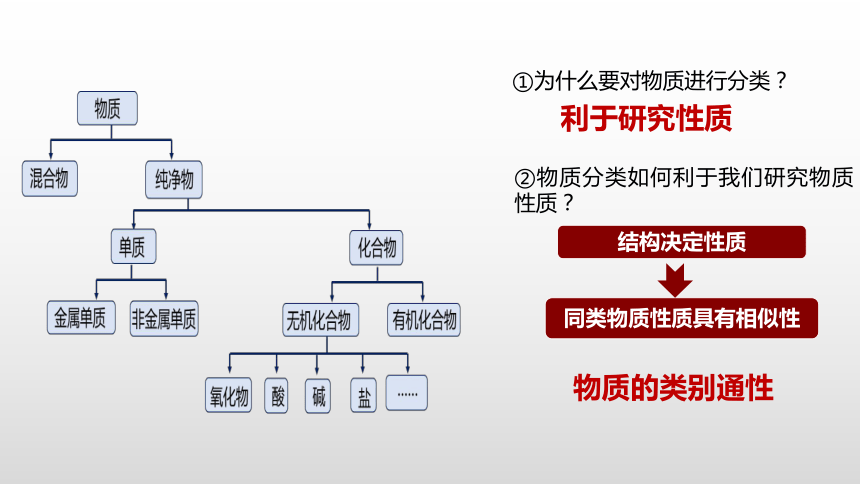
①為什么要對物質(zhì)進行分類?
利于研究性質(zhì)
同類物質(zhì)性質(zhì)具有相似性
結(jié)構(gòu)決定性質(zhì)
②物質(zhì)分類如何利于我們研究物質(zhì)性質(zhì)?
物質(zhì)的類別通性
【任務(wù)一】金屬單質(zhì)的通性
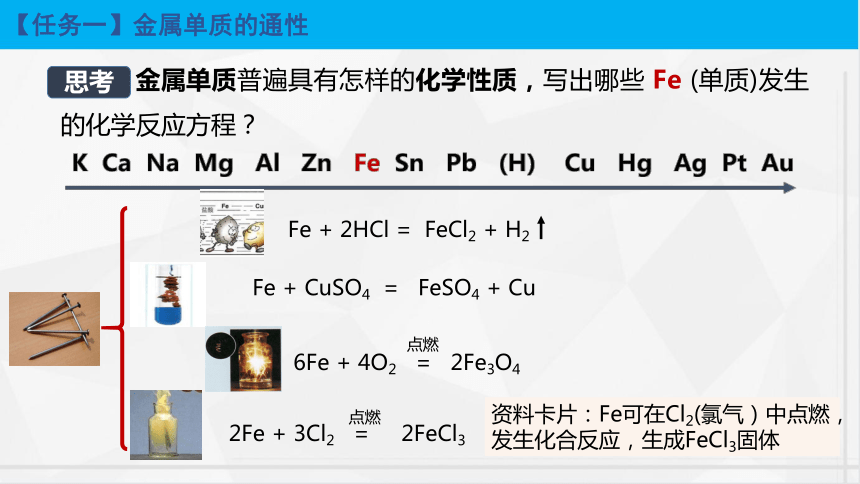
金屬單質(zhì)普遍具有怎樣的化學(xué)性質(zhì),寫出哪些 Fe (單質(zhì))發(fā)生的化學(xué)反應(yīng)方程?
思考
Fe + 2HCl = FeCl2 + H2
Fe + CuSO4 = FeSO4 + Cu
6Fe + 4O2 = 2Fe3O4
點燃
2Fe + 3Cl2 = 2FeCl3
點燃
資料卡片:Fe可在Cl2(氯氣)中點燃,發(fā)生化合反應(yīng),生成FeCl3固體
【任務(wù)一】金屬單質(zhì)的通性
Fe + 2HCl FeCl2 + H2
Fe + CuSO4 FeSO4 + Cu
6Fe + 4O2 2Fe3O4
2Fe + 3Cl2 2FeCl3
點燃
點燃
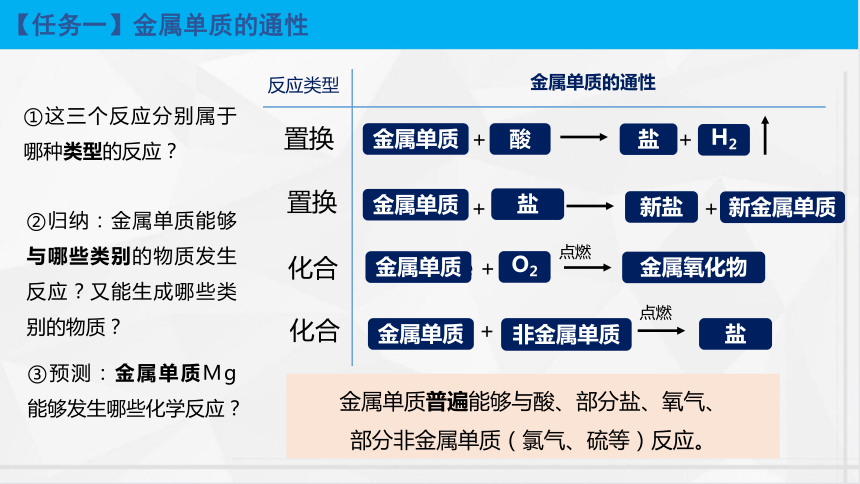
②歸納:金屬單質(zhì)能夠與哪些類別的物質(zhì)發(fā)生反應(yīng)?又能生成哪些類別的物質(zhì)?
①這三個反應(yīng)分別屬于哪種類型的反應(yīng)?
金屬單質(zhì)
酸
鹽
金屬單質(zhì)
鹽
新鹽
新金屬單質(zhì)
金屬單質(zhì)
O2
金屬氧化物
H2
金屬單質(zhì)
非金屬單質(zhì)
鹽
置換
置換
化合
化合
反應(yīng)類型
金屬單質(zhì)的通性
金屬單質(zhì)普遍能夠與酸、部分鹽、氧氣、
部分非金屬單質(zhì)(氯氣、硫等)反應(yīng)。
③預(yù)測:金屬單質(zhì)Mg能夠發(fā)生哪些化學(xué)反應(yīng)?
方法總結(jié)
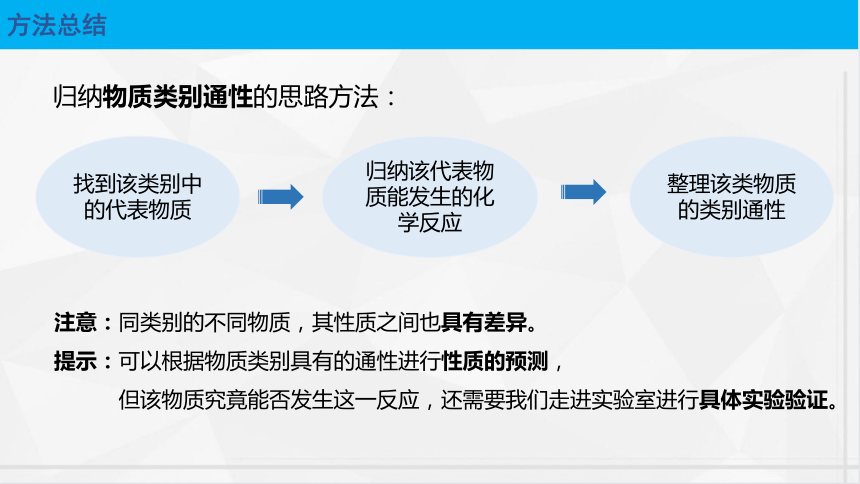
歸納物質(zhì)類別通性的思路方法:
找到該類別中的代表物質(zhì)
歸納該代表物質(zhì)能發(fā)生的化學(xué)反應(yīng)
整理該類物質(zhì)的類別通性
注意:同類別的不同物質(zhì),其性質(zhì)之間也具有差異。
提示:可以根據(jù)物質(zhì)類別具有的通性進行性質(zhì)的預(yù)測,
但該物質(zhì)究竟能否發(fā)生這一反應(yīng),還需要我們走進實驗室進行具體實驗驗證。
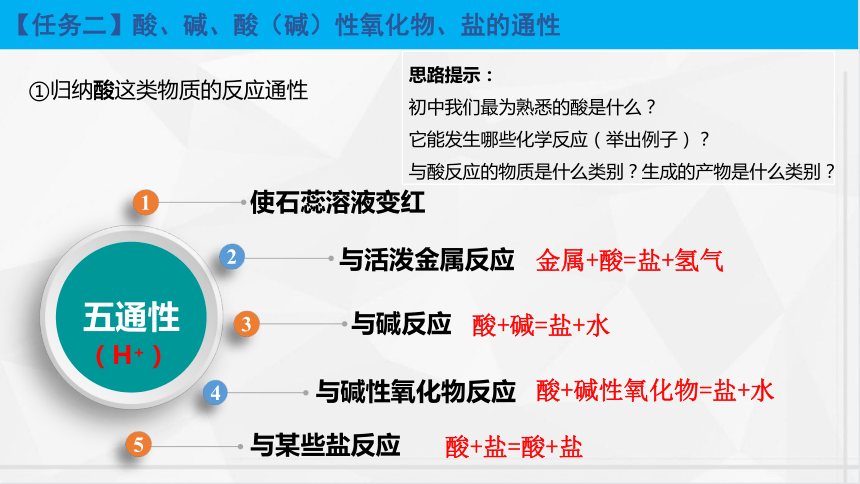
【任務(wù)二】酸、堿、酸(堿)性氧化物、鹽的通性
①歸納酸這類物質(zhì)的反應(yīng)通性
思路提示:
初中我們最為熟悉的酸是什么?
它能發(fā)生哪些化學(xué)反應(yīng)(舉出例子)?
與酸反應(yīng)的物質(zhì)是什么類別?生成的產(chǎn)物是什么類別?
五通性
5
與某些鹽反應(yīng)
酸+鹽=酸+鹽
(H+)
2
與活潑金屬反應(yīng)
3
與堿反應(yīng)
4
與堿性氧化物反應(yīng)
1
使石蕊溶液變紅
金屬+酸=鹽+氫氣
酸+堿性氧化物=鹽+水
酸+堿=鹽+水
②歸納堿這類物質(zhì)的反應(yīng)通性
四通性
思路提示:
初中我們最為熟悉的堿是什么?
它能發(fā)生哪些化學(xué)反應(yīng)(舉出例子)?
與堿反應(yīng)的物質(zhì)是什么類別?生成的產(chǎn)物是什么類別?
(OH-)
堿+酸性氧化物=鹽+水
2
與酸反應(yīng)
3
與酸性氧化物堿反應(yīng)
4
與鹽反應(yīng)
1
使石蕊溶液變藍,使酚酞變化
堿+酸=鹽+氫氣
堿+鹽=堿+鹽
【任務(wù)二】酸、堿、酸(堿)性氧化物、鹽的通性
③、以CO2為代表物質(zhì),歸納酸性氧化物的反應(yīng)通性
酸性氧化物
水
+
酸
堿
+
鹽
H2O
+
堿性氧化物
水
+
酸
酸
+
鹽
H2O
+
④、以CaO為代表物質(zhì),參考酸性氧化物性質(zhì),預(yù)測堿性氧化物的反應(yīng)通性
酸性氧化物
酸性氧化物
+
鹽
【任務(wù)二】酸、堿、酸(堿)性氧化物、鹽的通性
⑤歸納鹽這類物質(zhì)的反應(yīng)通性
思路提示:
初中我們最為熟悉的鹽是什么?
它能發(fā)生哪些化學(xué)反應(yīng)(舉出例子)?
與鹽反應(yīng)的物質(zhì)是什么類別?生成的產(chǎn)物是什么類別?
四通性
鹽+堿=鹽+堿
2
與酸反應(yīng)
3
與堿反應(yīng)
4
與鹽反應(yīng)
1
與金屬單質(zhì)反應(yīng)
鹽+酸=鹽+酸
鹽+鹽=鹽+鹽
單質(zhì)+鹽=鹽+單質(zhì)
【任務(wù)二】酸、堿、酸(堿)性氧化物、鹽的通性
SO2
酸性氧化物
預(yù)測SO2的性質(zhì)
SO2 + H2O = H2SO3
Na2O + CO2 = Na2CO3
思考:用化學(xué)方程式表示Na2O、SO2可能具有的化學(xué)性質(zhì)。
Na2O
堿性氧化物
預(yù)測Na2O的性質(zhì)
Na2O + HCl = 2NaCl + H2O
Na2O + H2O = 2NaOH
SO2 + CaO = CaSO3
基于物質(zhì)類別研究物質(zhì)性質(zhì)的認知模型
SO2 + 2NaOH = Na2SO3+2H2O
確定
物質(zhì)
類別
依據(jù)類別通性
類比典型代表物
實驗
驗證
預(yù)測
物質(zhì)
性質(zhì)
確認
物質(zhì)
性質(zhì)
分析物質(zhì)
組成
【任務(wù)三】物質(zhì)的轉(zhuǎn)化
借助物質(zhì)的類別通性,思考如何實現(xiàn)下列箭頭所指的轉(zhuǎn)化過程,并寫出反應(yīng)方程。
金屬單質(zhì)
堿性氧化物
堿
鹽
Ca
CaO
Ca(OH)2
CaSO4
CaO + H2O Ca(OH)2
O2
H2O
酸
酸性氧化物
2Ca + O2 2CaO
Ca(OH)2 + H2SO4 CaSO4 + 2H2O
Ca(OH)2 + SO3 CaSO4 + H2O
物
質(zhì)
轉(zhuǎn)
化
規(guī)
律
的
認
知
模
型
【任務(wù)三】物質(zhì)的轉(zhuǎn)化
借助物質(zhì)的類別通性,思考如何實現(xiàn)下列箭頭所指的轉(zhuǎn)化過程,并寫出反應(yīng)方程。
非金屬單質(zhì)
酸性氧化物
酸
鹽
CO2 + H2O H2CO3
O2
H2O
堿
堿性氧化物
C
CO2
H2CO3
CaCO3
H2CO3+ Ca(OH)2 CaCO3 + 2H2O
H2CO3+ CaO CaCO3 + H2O
C + O2 CO2
物
質(zhì)
轉(zhuǎn)
化
規(guī)
律
的
認
知
模
型
金屬
單質(zhì)
堿
鹽
酸
鹽
鹽
鹽和水
堿性
氧化物
酸性
氧化物
非金屬
單質(zhì)
堿和鹽
酸和鹽
另兩種鹽
金屬和鹽
氫氣和鹽
單質(zhì)、酸、堿、酸(堿)性氧化物、鹽轉(zhuǎn)化關(guān)系總結(jié)
制取某種堿
堿性氧化物與水反應(yīng)
一種方法
鹽與另一種堿反應(yīng)
另一種方法
制取NaOH
一種方法
Na2O與H2O反應(yīng)
另一種方法
Na2CO3與Ca(OH)2反應(yīng)
工業(yè)
來源少、成本高
電解飽和食鹽水
主要方法
【任務(wù)三】物質(zhì)的轉(zhuǎn)化
工業(yè)生產(chǎn):需要考慮反應(yīng)進行的可能性、原料來源、成本高低和設(shè)備要求等因素。
展開更多......
收起↑
 資源預(yù)覽
資源預(yù)覽