資源簡介
資源簡介
(共21張PPT)
第三章 第三節
醛 酮
新課導入
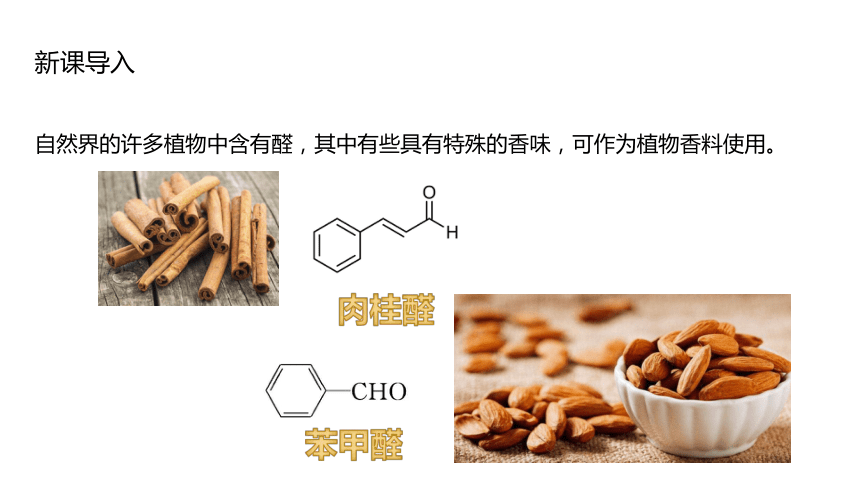
自然界的許多植物中含有醛,其中有些具有特殊的香味,可作為植物香料使用。
肉桂醛
苯甲醛
醛
醛是由烴基(或氫原子)與醛基相連而構成的化合物,簡寫為RCHO。
醛的官能團:醛基(—CHO)
飽和一元醛的通式為CnH2nO。
乙醛:乙醛是無色、具有刺激性氣味的液體,密度比水的小,沸點20.8 ℃,易揮發,易燃燒,能與水、乙醇等互溶。
醛
名稱 甲醛 苯甲醛
結構簡式 HCHO
俗稱 蟻醛 苦杏仁油
物理性質 顏色 無色 無色
氣味 強烈刺激性氣味 苦杏仁氣味
狀態 氣體 液體
溶解性 易溶于水 —
用途 合成多種有機化合物;福爾馬林(甲醛水溶液)可用于消毒和制作生物標本 制造染料、香料及藥物的重要原料
乙醛
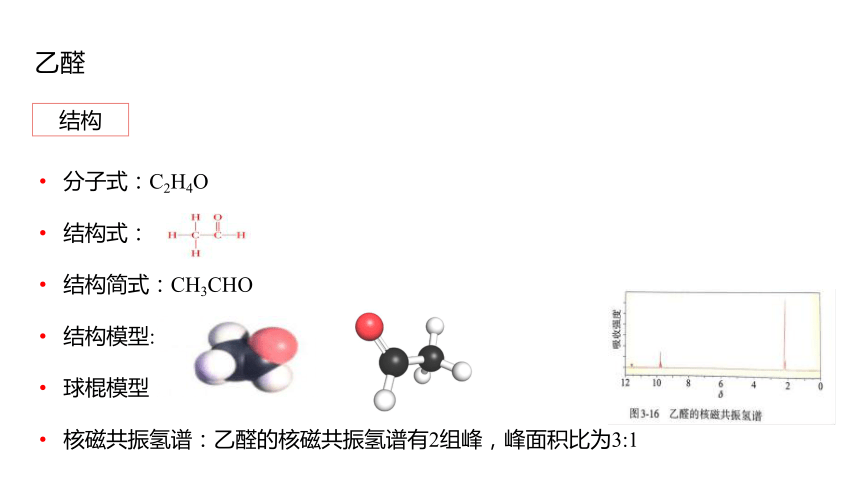
結構
分子式:C2H4O
結構式:
結構簡式:CH3CHO
結構模型:
球棍模型:
核磁共振氫譜:乙醛的核磁共振氫譜有2組峰,峰面積比為3:1
乙醛
化學性質
加成反應
催化加氫
乙醛蒸氣和氫氣的混合氣體通過熱的鎳催化劑,乙醛與氫氣即發生催化加氫反應,得到乙醇。
乙醛
化學性質
加成反應
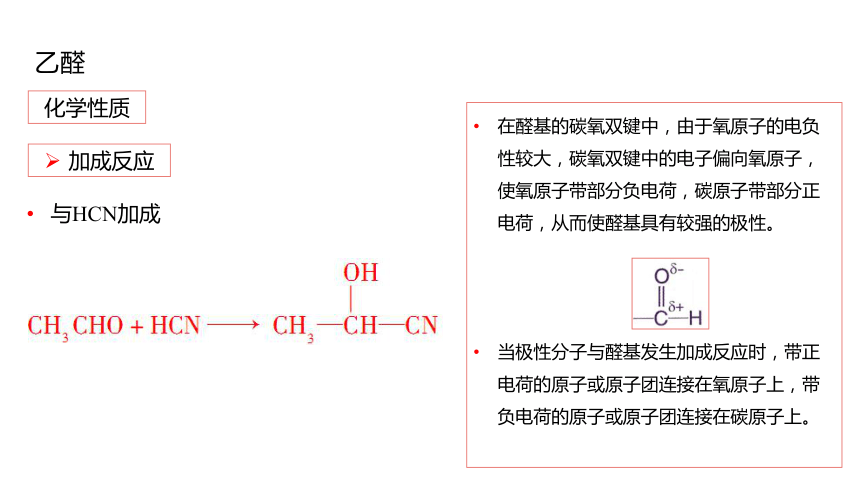
與HCN加成
在醛基的碳氧雙鍵中,由于氧原子的電負性較大,碳氧雙鍵中的電子偏向氧原子,使氧原子帶部分負電荷,碳原子帶部分正電荷,從而使醛基具有較強的極性。
當極性分子與醛基發生加成反應時,帶正電荷的原子或原子團連接在氧原子上,帶負電荷的原子或原子團連接在碳原子上。
實驗3-7:銀鏡反應
實驗方案:在潔凈的試管中加入1 mL2% AgNO3溶液,然后邊振蕩試管邊逐滴滴入2%氨水,使最初產生的沉淀溶解,制得銀氨溶液。再滴入3滴乙醛,振蕩后將試管放在熱水浴中溫熱。觀察實驗現象。
實驗現象:A中現象:先產生白色沉淀后變澄清。D中現象:試管內壁出現一層光亮的銀鏡
實驗結論:硝酸銀與氨水生成的銀氨溶液中含有[Ag(NH3)2]OH(氫氧化二氨合銀),它是一種弱氧化劑,能把乙醛氧化成乙酸,而Ag被還原成Ag。
乙醛
化學方程式:
應用:檢驗醛基
乙醛
AgNO3 + NH3·H2O = AgOH↓(白色) + NH4NO3AgOH + 2NH3·H2O = [Ag(NH3)2]OH + 2H2O
實驗3-7:銀鏡反應
實驗3-8:與新制的Cu(OH)2反應
實驗方案:在試管里加入2 mL 10% NaOH溶液,加入5滴5%CuSO4溶液,得到新制的Cu(OH)2,振蕩后加入0.5 mL乙醛溶液,加熱。觀察實驗現象。
實驗現象:A中溶液出現藍色絮狀沉淀,C中有磚紅色沉淀產生。
實驗結論:新制的Cu(OH)2是—種弱氧化劑,能使乙醛氧化。該反應生成了磚紅色Cu2O沉淀。
乙醛
化學方程式:
應用:檢驗醛基
乙醛
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4
實驗3-8:與新制的Cu(OH)2反應
乙醛
醛類的兩個特征反應及—CHO的檢驗
特征反應 銀鏡反應 與新制的Cu(OH)2反應
現象 產生光亮的銀鏡 產生磚紅色沉淀
注意 事項 (1)試管內壁必須潔凈。 (2)銀氨溶液隨用隨配,不可久置。 (3)水浴加熱,不可用酒精燈直接加熱。 (4)醛用量不宜太多,如乙醛一般滴3滴。 (5)銀鏡可用稀硝酸浸泡洗滌除去 (1)新制的Cu(OH)2要隨用隨配,不可久置。
(2)配制新制的Cu(OH)2時,所用NaOH溶液必須過量
醇、乙醛和乙酸三者之間的轉化關系如下圖所示,結合具體反應和三者的分子結構、官能團的變化情況,談談有機反應中的氧化反應和還原反應的特點。
乙醛
思考與討論
乙醛
化學性質
氧化反應
催化氧化
2CH3CHO+O2 2CH3COOH。
2CH3CHO+5O2 4CO2+4H2O
燃燒
乙醛
深化拓展
醛的氧化與還原規律
相關定量計算
一元醛發生銀鏡反應或與新制的Cu(OH)2反應時,量的關系如下:
由丙醛如何得到1-丙醇或丙酸
乙醛
思考與討論
苯甲醛在空氣中久置,在客器內壁會出現苯甲酸的結晶,這是為什么
苯甲醛在空氣中久置被氧化為苯甲酸
乙醛能不能使酸性高錳酸鉀溶液褪色
酸性高錳酸鉀溶液屬于強氧化劑,故乙醛能使酸性高錳酸鉀溶液褪色。
酮
丙酮
物理性質
丙酮是無色透明的液體,沸點56.2℃,易揮發,能與水、乙醇等互溶。
結構
化學性質
丙酮不能被銀氨溶液、新制的Cu(OH)2等弱氧化劑氧化。
在催化劑存在的條件下,丙酮可以發生催化加氫反應,生成2-丙醇。
酮是重要的有機溶劑和化工原料。例如,丙酮可用作化學纖維、鋼瓶儲存乙炔等的溶劑,還用于生產有機玻璃、農藥和涂料等。
丙酮
應用
丙酮是丙醛的同分異構體嗎 它們有哪些性質差異 可采用哪些方法鑒別它們
丙酮
思考與討論
丙酮與丙醛互為同分異構體
丙酮可發生還原反應,卻不與銀氨溶液和新制的氫氧化銅反應
丙醛可發生氧化反應、還原反應、與銀氨溶液和新制的氫氧化銅反應
丙酮與丙醛可用銀氨溶液和新制的氫氧化銅反應鑒別。
本節小結
展開更多......
收起↑
 資源預覽
資源預覽