資源簡介
資源簡介
(共76張PPT)
章末綜合提升
第二章 海水中的重要元素——鈉和氯
概念梳理 構(gòu)建體系
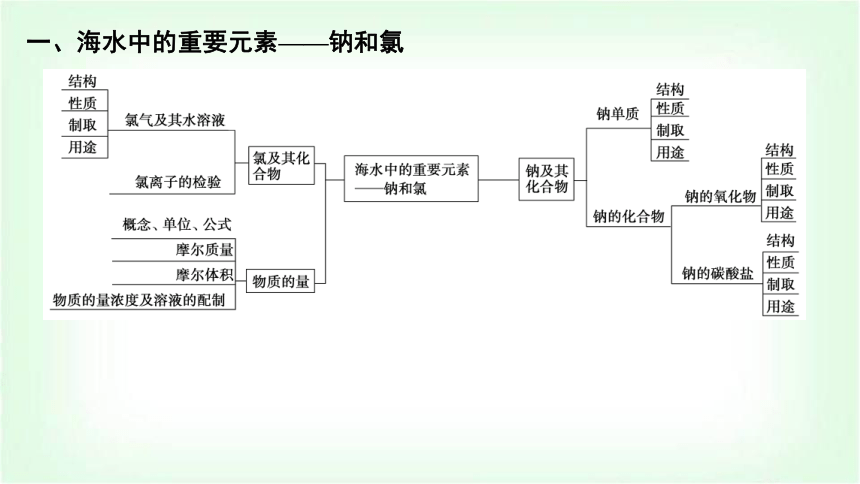
一、海水中的重要元素——鈉和氯
二、物質(zhì)的量
返回
分層突破 提升能力
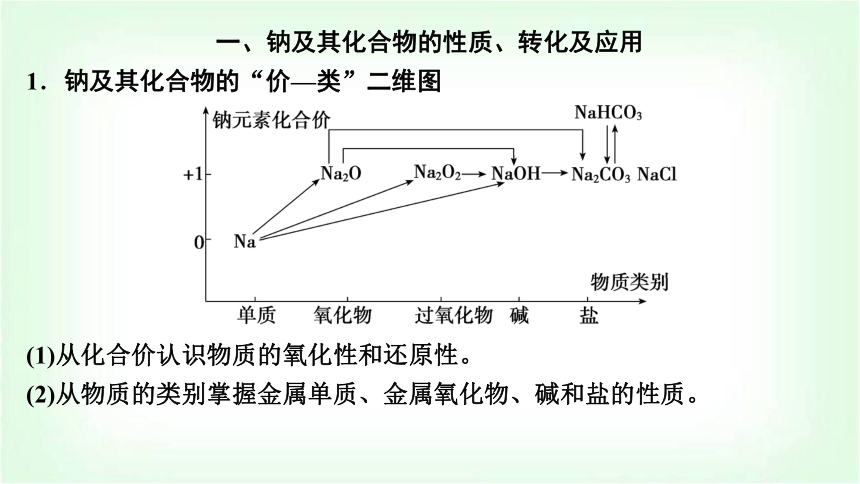
一、鈉及其化合物的性質(zhì)、轉(zhuǎn)化及應(yīng)用
1.鈉及其化合物的“價(jià)—類”二維圖
(1)從化合價(jià)認(rèn)識(shí)物質(zhì)的氧化性和還原性。
(2)從物質(zhì)的類別掌握金屬單質(zhì)、金屬氧化物、堿和鹽的性質(zhì)。
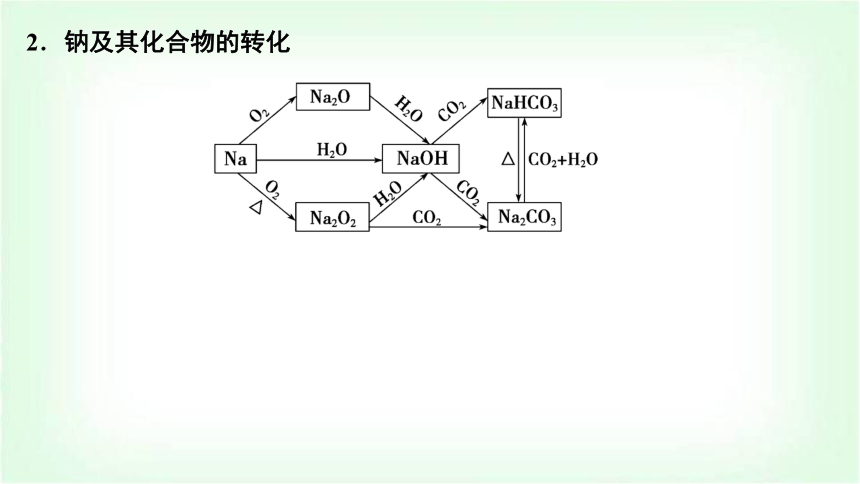
2.鈉及其化合物的轉(zhuǎn)化
3.鈉及其化合物的重要性質(zhì)和應(yīng)用
物質(zhì) 日常應(yīng)用 原因分析
過氧化鈉 呼吸面具或潛水艇中作為氧氣來源 2Na2O2+2CO2===2Na2CO3+O2
2Na2O2+2H2O===4NaOH+O2↑
氯化鈉 氨堿法制純堿 NaCl+H2O+NH3+CO2===NaHCO3↓+NH4Cl
2NaHCO3 Na2CO3+ H2O+CO2↑
調(diào)味劑 具有咸味
配制生理鹽水(0.9%) 體液替代物
碳酸氫鈉 發(fā)酵粉、膨松劑 2NaHCO3 Na2CO3+H2O+CO2↑
胃酸中和劑 HCO +H+===H2O+CO2↑
√
針對(duì)練1.膨松劑是一種食品添加劑,它受熱分解產(chǎn)生的氣體,能使面胚在焙烤過程中變得松軟、多孔。碳酸氫鈉(NaHCO3)受熱后發(fā)生分解反應(yīng)生成二氧化碳、水和碳酸鈉,是常用的膨松劑之一,它既可以作為堿性膨松劑單獨(dú)使用,也可以與酒石酸氫鉀、淀粉按一定比例混合制成復(fù)合膨松劑,復(fù)合膨松劑遇水會(huì)產(chǎn)生二氧化碳,起到膨松作用。下列說法正確的是
A.任何受熱分解能產(chǎn)生氣體的物質(zhì)都可以做食品膨松劑
B.碳酸氫鈉受熱分解的化學(xué)方程式為NaHCO3 CO2↑+H2O+Na2CO3
C.碳酸氫鈉做膨松劑時(shí),必須與酒石酸氫鉀、淀粉混合使用
D.復(fù)合膨松劑應(yīng)在干燥的環(huán)境中保存
有的物質(zhì)受熱分解產(chǎn)生有毒氣體,不可以做食品膨松劑,故A錯(cuò)誤;碳酸氫鈉受熱分解的化學(xué)方程式為2NaHCO3 CO2↑+H2O+Na2CO3,故B錯(cuò)誤;碳酸氫鈉可以作為堿性膨松劑單獨(dú)使用,故C錯(cuò)誤;復(fù)合膨松劑遇水會(huì)產(chǎn)生二氧化碳,所以復(fù)合膨松劑應(yīng)在干燥的環(huán)境中保存,故D正確。
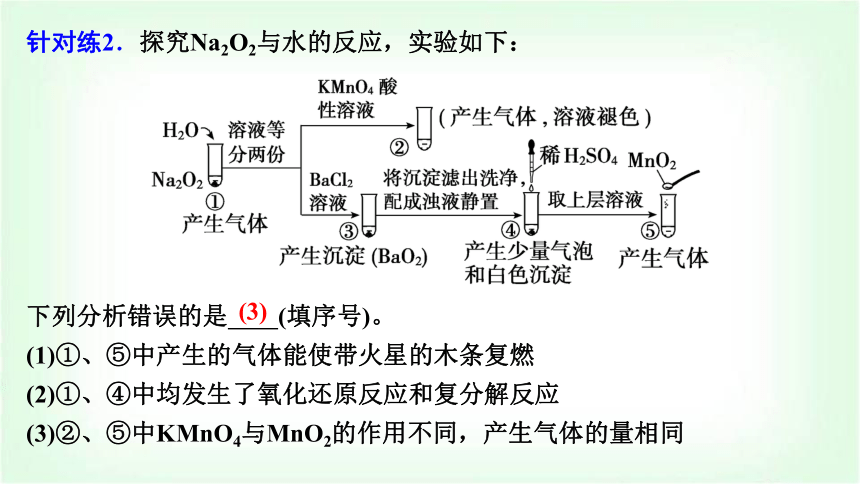
針對(duì)練2.探究Na2O2與水的反應(yīng),實(shí)驗(yàn)如下:
下列分析錯(cuò)誤的是 (填序號(hào))。
(1)①、⑤中產(chǎn)生的氣體能使帶火星的木條復(fù)燃
(2)①、④中均發(fā)生了氧化還原反應(yīng)和復(fù)分解反應(yīng)
(3)②、⑤中KMnO4與MnO2的作用不同,產(chǎn)生氣體的量相同
(3)
試管①中Na2O2與H2O反應(yīng)產(chǎn)生O2,試管⑤中H2O2在MnO2的催化作用下生成O2,因此試管①、⑤中產(chǎn)生的氣體都能使帶火星的木條復(fù)燃,(1)正確。試管①中H2O2分解產(chǎn)生O2的反應(yīng)為氧化還原反應(yīng),Na2O2與H2O的反應(yīng)為復(fù)分解反應(yīng);試管④中加入稀硫酸發(fā)生的反應(yīng)為:BaO2+H2SO4===BaSO4+H2O2、2H2O2===2H2O+O2↑,前者為復(fù)分解反應(yīng),后者為氧化還原反應(yīng),(2)正確。試管②中KMnO4為氧化劑,試管⑤中MnO2為催化劑,二者的作用不同,由于溶液中所含H2O2的量不同,因此反應(yīng)生成O2的量不同,(3)錯(cuò)誤。
針對(duì)練3.如圖表示A~E五種物質(zhì)間的相互轉(zhuǎn)化關(guān)系,
其中A為淡黃色固體,B為單質(zhì)。回答下列問題:
(1)寫出各物質(zhì)的化學(xué)式:A: ,B: ,
C: ,D: ,E: 。
(2)寫出B→C、D→E反應(yīng)的離子方程式。
B→C: ;
D→E: 。
Na2O2
Na
NaOH
Na2CO3
NaCl
2Na+2H2O===2Na++2OH-+H2↑
A是淡黃色固體,A是Na2O2;B是單質(zhì),可制取A,則B是Na;A與CO2反應(yīng)生成D,則D為Na2CO3;B與Cl2反應(yīng)生成E,則E為NaCl;Na2O2、Na都能生成C,則C為NaOH。
二、氯及其化合物的性質(zhì)、轉(zhuǎn)化及應(yīng)用
1.氯及其化合物的“價(jià)—類”二維圖
(1)同價(jià)態(tài)之間的轉(zhuǎn)化主要是酸性氧化物、酸和鹽之間的化合反應(yīng)或復(fù)分解反應(yīng)。
(2)同種元素不同價(jià)態(tài)之間的轉(zhuǎn)化分“歧化” 和“歸中”。
2.氯氣及其化合物的轉(zhuǎn)化
3.氯水的組成及性質(zhì)在應(yīng)用中的常見誤區(qū)
(1)氯水中因HClO見光分解,隨著HClO的消耗,最后成為鹽酸,故久置氯水酸性增加,無漂白性。因此,氯水要現(xiàn)用現(xiàn)配。
(2)制取氯水的反應(yīng)為Cl2+H2O ??HCl+HClO,反應(yīng)中Cl2既是氧化劑,又是還原劑,且1 mol Cl2參加反應(yīng),轉(zhuǎn)移電子數(shù)為NA。
(3)Cl2盡管有較強(qiáng)的氧化性,但沒有漂白性,氯水具有漂白性是因?yàn)镃l2與水反應(yīng)生成了強(qiáng)氧化性的HClO。
(4)ClO-與Fe2+、I-、S2-、HS-、SO 等在水中因發(fā)生氧化還原反應(yīng)而不能大量共存。
4.氯及其化合物的重要性質(zhì)和應(yīng)用
物質(zhì) 日常應(yīng)用 原因分析
次氯酸 殺菌消毒劑、漂白劑 具有強(qiáng)氧化性
ClO2 殺菌消毒劑 具有強(qiáng)氧化性
漂白液(有效成分為NaClO)、漂白粉[有效成分為Ca(ClO)2]、漂粉精[有效成分為Ca(ClO)2] 殺菌消毒劑、漂白劑 與空氣中的CO2反應(yīng),產(chǎn)生具有強(qiáng)氧化性的次氯酸
√
針對(duì)練4.?dāng)?shù)字化實(shí)驗(yàn)是將傳感器、數(shù)據(jù)采集器和計(jì)算機(jī)連接起來,采集實(shí)驗(yàn)過程中各種物理量變化的數(shù)據(jù)。如圖是用強(qiáng)光照射廣口瓶中新制氯水時(shí)所獲得的圖像,下列縱坐標(biāo)代表的物理量與圖像不相符的是
A.溶液顏色
B.溶液中氫離子的數(shù)目
C.瓶中氧氣的體積分?jǐn)?shù)
D.溶液的導(dǎo)電能力
在氯水中存在如下反應(yīng):Cl2+H2O HCl+HClO、2HClO
2HCl+O2↑。在強(qiáng)光照射下,新制氯水變質(zhì),生成鹽酸,鹽酸為無色溶液,所以溶液顏色不斷變淺,A符合題意;若光照時(shí)間充足,溶液最終變成HCl溶液,所以溶液中氫離子數(shù)目不斷增加,B不符合題意;隨著光照時(shí)間的延長,HClO分解生成的氧氣量不斷增多,所以瓶中氧氣的體積分?jǐn)?shù)不斷增大,C不符合題意;氯水不斷用強(qiáng)光照射,最終變?yōu)橄←}酸,溶液中分子轉(zhuǎn)化為離子,單位體積溶液中離子數(shù)目增大,溶液的導(dǎo)電能力增強(qiáng),D不符合題意。
針對(duì)練5.亞氯酸鈉(NaClO2)是一種高效的消毒劑和漂白劑。Mathieson法制備亞氯酸鈉的流程如下:
與傳統(tǒng)消毒劑Cl2比較,NaClO2消毒效率是Cl2的 倍(以單位質(zhì)量得到的電子數(shù)表示,還原產(chǎn)物均是Cl-,計(jì)算結(jié)果保留兩位小數(shù))。
1.57
針對(duì)練6.現(xiàn)有A、B、C三種氣體,A是密度最小的氣體,B在通常情況下呈黃綠色,純凈的A可以在B中安靜地燃燒生成C。把氣體B通入適量石灰乳中可以得到白色渾濁物D。請(qǐng)據(jù)此回答下列問題:
(1)寫出下列反應(yīng)的離子方程式。
①將氣體B通入水中: ;
②將氣體B通入NaOH溶液中: 。
(2)把三種氣體分別通入酸化的硝酸銀溶液中,出現(xiàn)白色沉淀的氣體是 ______(用字母表示)。
Cl2+H2O ??H++Cl-+HClO
Cl2+2OH-===Cl-+ClO-+H2O
BC
(3)將白色渾濁物D溶于水得到澄清溶液,向該溶液中滴加碳酸鈉溶液觀察到出現(xiàn)沉淀,發(fā)生反應(yīng)的化學(xué)方程式為 ;
。
CaCl2+Na2CO3===CaCO3↓+2NaCl
Ca(ClO)2+Na2CO3===CaCO3↓+2NaClO
A是密度最小的氣體,A為氫氣;B在通常情況下呈黃綠色,B為氯氣;純凈的A可以在B中安靜地燃燒生成C,則C為氯化氫。把氯氣通入適量石灰乳中可以得到氯化鈣和次氯酸鈣的混合物,據(jù)此分析可得結(jié)論。
三、物質(zhì)的量、阿伏加德羅常數(shù)及其應(yīng)用
1.以物質(zhì)的量為中心的各個(gè)化學(xué)計(jì)量之間的關(guān)系
2.氣體摩爾質(zhì)量的計(jì)算
(1)由單個(gè)分子真實(shí)質(zhì)量求:M=m0×NA,其中m0為單個(gè)分子的真實(shí)質(zhì)量。
(2)由氣體的摩爾體積和密度求:在標(biāo)準(zhǔn)狀況下,M=Vm·ρ標(biāo)=22.4 L·mol-1
×ρ標(biāo)g·L-1。
(3)由相對(duì)密度求:在同溫同壓下,若A氣體相對(duì)B氣體的密度為D,MA=D·MB。
(4)摩爾質(zhì)量定義法:M= ,對(duì)于混合氣體,M= 。
針對(duì)練7.意大利羅馬大學(xué)的Fulvio Cacace等人獲得了極具理論研究意義的N4分子,N4分子的結(jié)構(gòu)如圖所示,下列說法正確的是
A.N4屬于一種新型化合物
B.N4與N2的摩爾質(zhì)量相等
C.等質(zhì)量的N4與N2所含原子的個(gè)數(shù)比為1∶1
D.等質(zhì)量的N4與N2所含分子的個(gè)數(shù)比為2∶1
N4屬于單質(zhì),A錯(cuò)誤;N4與N2的摩爾質(zhì)量分別為56 g·mol-1和28 g·mol-1,B錯(cuò)誤;等質(zhì)量的N4與N2的物質(zhì)的量之比為1∶2,所含原子的個(gè)數(shù)比為1∶1,C正確;等質(zhì)量的N4與N2的物質(zhì)的量之比為1∶2,所含分子的個(gè)數(shù)比為1∶2,D錯(cuò)誤。
√
(2)在25 ℃、101 kPa的條件下,等質(zhì)量的CH4和A氣體的體積之比為15∶8,則A的摩爾質(zhì)量為 。
針對(duì)練8.(1)標(biāo)準(zhǔn)狀況下,1.92 g某氣體的體積為672 mL,則此氣體的相對(duì)分子質(zhì)量為 。
64
30 g/mol
(3)相同條件下,H2和O2的體積比為a∶b和質(zhì)量比為a∶b的混合氣體,其平均相對(duì)分子質(zhì)量分別是 和 。
返回
教考銜接 明確考向
√
1.設(shè)NA為阿伏加德羅常數(shù)的值,下列敘述正確的是
A.1.7 g H2O2中含有氧原子數(shù)為0.2NA(2023·浙江6月選考,7B)
B.標(biāo)準(zhǔn)狀況下,11.2 L Cl2通入水中,溶液中氯離子數(shù)為0.5NA(2023·浙江6月選考,7D)
C.足量的濃鹽酸與8.7 g MnO2反應(yīng),轉(zhuǎn)移電子的數(shù)目為0.4NA(2022·浙江1月選考,12C)
D.我國古代四大發(fā)明之一黑火藥的爆炸反應(yīng)為:S+2KNO3+3C===K2S+N2↑+3CO2↑。每生成2.8 g N2轉(zhuǎn)移電子數(shù)目為1.2NA(2023·遼寧卷,5B改編)
√
2.設(shè)NA為阿伏加德羅常數(shù)的值,下列敘述正確的是
A.1 mol·L-1 HCl溶液中,HCl分子的數(shù)目為NA(2021·天津卷,7A)
B.22.4 L氫氣中,H2分子的數(shù)目為NA(2021·天津卷,7B)
C.180 g葡萄糖(C6H12O6)中,C原子的數(shù)目為6NA(2021·天津卷,7C)
D.23 g Na與足量H2O反應(yīng)生成的H2分子數(shù)目為NA(2021·廣東卷,11D)
3.(2022·廣東卷,8)實(shí)驗(yàn)室用MnO2和濃鹽酸反應(yīng)生成Cl2后,按照凈化、收集、性質(zhì)檢驗(yàn)及尾氣處理的順序進(jìn)行實(shí)驗(yàn)。下列裝置(“→”表示氣流方向)不能達(dá)到實(shí)驗(yàn)?zāi)康牡氖?br/>√
4.下列說法不正確的是 (填字母)。
A.工業(yè)制備HCl反應(yīng):H2+Cl2 2HCl(2023·遼寧卷,3B)
B.過氧化鈉能與二氧化碳反應(yīng)生成氧氣,可作潛水艇中的供氧劑(2023·浙江6月選考,4D)
C.高壓鈉燈發(fā)出的黃光透霧能力強(qiáng)、射程遠(yuǎn),可用于道路照明(2022·浙江6月選考,8B)
D.面包師用小蘇打作發(fā)泡劑烘焙面包,是因?yàn)镹a2CO3 可與酸反應(yīng)(2022·廣東卷,6A)
E.氯氣、臭氧、二氧化氯都可用于飲用水的消毒(2022·浙江1月選考,8C)
D
5.[2021·廣東卷,17(1)(2)(3)]含氯物質(zhì)在生產(chǎn)生活中有重要作用。1774年,舍勒在研究軟錳礦(主要成分是MnO2)的過程中,將它與濃鹽酸混合加熱,產(chǎn)生了一種黃綠色氣體。1810年,戴維確認(rèn)這是一種新元素組成的單質(zhì),并命名為chlorine(中文命名“氯氣”)。
(1)實(shí)驗(yàn)室沿用舍勒的方法制取Cl2的化學(xué)方程式為_____________________
_____________________。
(2)實(shí)驗(yàn)室制取干燥Cl2時(shí),凈化與收集Cl2所需裝置的接口連接順序?yàn)? 。
MnCl2+Cl2↑+2H2O
c→d→b→a→e
(3)某氯水久置后不能使品紅溶液褪色,可推測氯水中 已分解。檢驗(yàn)此久置氯水中Cl-存在的操作及現(xiàn)象是 ____________________________
________________________________________________________________
_______________________________。
HClO
向溶液中加入過量稀硝酸,防
6.(2020·全國卷Ⅲ,26節(jié)選)氯可形成多種含氧酸鹽,廣泛應(yīng)用于殺菌、消毒及化工領(lǐng)域。實(shí)驗(yàn)室中利用下圖裝置(部分裝置省略)制備KClO3和NaClO,探究其氧化還原性質(zhì)。
回答下列問題:
(1)盛放MnO2粉末的儀器名稱是 ,a中的試劑為 。
圓底燒瓶
飽和食鹽水
由題干信息及裝置圖分析各裝置的作用,a裝置用于除雜,b裝置用于制備氯酸鉀,c裝置用于制備次氯酸鈉,d裝置用于尾氣處理。盛放MnO2粉末的儀器是圓底燒瓶。產(chǎn)生的氯氣中混有氯化氫雜質(zhì),除掉氯化氫需要將氣體通過飽和食鹽水。
(2)b中采用的加熱方式是 ,c中化學(xué)反應(yīng)的離子方程式是 ______
,采用冰水浴冷卻的目是 。
水浴加熱
2OH-===ClO-+Cl-+H2O
避免生成NaClO3
Cl2+
由題干信息及裝置圖分析各裝置的作用,a裝置用于除雜,b裝置用于制備氯酸鉀,c裝置用于制備次氯酸鈉,d裝置用于尾氣處理。b裝置的加熱方式為水浴加熱。c裝置中氯氣與氫氧化鈉發(fā)生反應(yīng)的離子方程式為Cl2+2OH-===ClO-+Cl-+H2O。根據(jù)b、c裝置水浴溫度的不同推知,生成氯酸鹽時(shí)需要酒精燈加熱,生成次氯酸鹽時(shí)需要冰水冷卻,所以c中冰水浴的目的是避免氯酸鈉的生成。
(3)d的作用是 ,可選用試劑 (填字母)。
A.Na2S B.NaCl C.Ca(OH)2 D.H2SO4
吸收尾氣(Cl2)
AC
由題干信息及裝置圖分析各裝置的作用,a裝置用于除雜,b裝置用于制備氯酸鉀,c裝置用于制備次氯酸鈉,d裝置用于尾氣處理。d是尾氣處理裝置,吸收氯氣可以用硫化鈉溶液或氫氧化鈣濁液。
返回
單元檢測卷
√
1.下列有關(guān)物質(zhì)保存的說法錯(cuò)誤的是
A.鈉保存在煤油中
B.過氧化鈉需密封保存
C.氯水密封保存在無色試劑瓶中
D.漂白粉不能露置在空氣中保存
鈉應(yīng)該密封在煤油中保存,A正確;過氧化鈉露置在空氣中能與二氧化碳、水反應(yīng)而變質(zhì),應(yīng)密封保存,B正確;氯水中含次氯酸見光分解,氯水應(yīng)該密封在棕色試劑瓶中保存,C錯(cuò)誤;漂白粉中次氯酸鈣能和空氣中二氧化碳、水反應(yīng)而變質(zhì),不能露置在空氣中保存,D正確。
√
2.(2023·大慶實(shí)驗(yàn)中學(xué)高一期中)下列鈉及其化合物的性質(zhì)與用途具有對(duì)應(yīng)關(guān)系的是
A.Na有還原性,可用于制造高壓鈉燈
B.Na2O2有漂白性,可用作呼吸面具的供氧劑
C.Na2CO3溶液有堿性,可用于治療胃酸過多
D.NaHCO3受熱易分解,可用于焙制糕點(diǎn)
√
鈉在空氣中表面被氧化生成白色物質(zhì),涉及化學(xué)變化,A不符合題意;銅器表面在空氣和水的作用下發(fā)生反應(yīng)生成銅綠,涉及化學(xué)變化,B不符合題意;用氯化鈉溶液做焰色試驗(yàn),是物理變化,不涉及化學(xué)變化,C符合題意;光照氯水,HClO分解,Cl2+H2O HCl+HClO平衡右移,Cl2濃度下降,溶液褪色,涉及化學(xué)變化,D不符合題意。
3.(2023·山西霍州高一統(tǒng)考)下列過程不涉及化學(xué)變化的是
A.鈉在空氣中表面生成白色物質(zhì)
B.銅器生銅綠
C.用氯化鈉溶液做焰色試驗(yàn)
D.光照氯水,溶液褪色
√
4.(2023·浙江樂清高一聯(lián)考)鈉單質(zhì)是一種非常活潑的金屬單質(zhì),將一粒黃豆大小的鈉單質(zhì)放在干凈、干燥的表面皿中,放在空氣中觀察,看到以下現(xiàn)象:開始鈉單質(zhì)表面變暗,五個(gè)小時(shí)后發(fā)現(xiàn)鈉單質(zhì)表面“出汗”,并伴有少量的氣泡產(chǎn)生,24小時(shí)后鈉固體消失,表面皿中形成溶液,48小時(shí)后溶液消失,逐漸形成無色的單斜晶體(主要成分為水合碳酸鈉),將晶體放在太陽下曬兩個(gè)小時(shí),幾乎完全轉(zhuǎn)化為白色粉末。下列對(duì)于上述過程的描述錯(cuò)誤的是
A.鈉單質(zhì)表面變暗是因?yàn)檠趸闪薔a2O
B.鈉單質(zhì)表面產(chǎn)生的氣泡是鈉與水反應(yīng)生成的H2
C.鈉消失后形成溶液,溶液溶質(zhì)的主要成分是Na2CO3
D.晶體在太陽下發(fā)生的化學(xué)反應(yīng)可能有Na2CO3·10H2O===Na2CO3+10H2O
鈉單質(zhì)表面變暗是因?yàn)殁c被空氣中的氧氣氧化生成了Na2O,A正確;鈉極易與水反應(yīng)生成氫氧化鈉和氫氣,鈉單質(zhì)表面產(chǎn)生的氣泡是鈉與水反應(yīng)生成的H2,B正確;鈉消失后形成了溶液,溶液中溶質(zhì)的主要成分是氫氧化鈉,C錯(cuò)誤;水合碳酸鈉晶體放在太陽下曬兩個(gè)小時(shí),幾乎完全轉(zhuǎn)化為白色粉末,因此晶體在太陽下發(fā)生的化學(xué)反應(yīng)可能有Na2CO3·10H2O===Na2CO3+10H2O,D正確。
√
5.(2023·廣東英德高一聯(lián)考)與50 mL 0.1 mol·L-1 Na2CO3溶液中Na+的物質(zhì)的量濃度相同的溶液是
A.50 mL 0.2 mol·L-1的NaCl溶液
B.100 mL 0.1 mol·L-1的Na3PO4溶液
C.25 mL 0.2 mol·L-1的Na2SO4溶液
D.10 mL 0.5 mol·L-1的Na2CO3溶液
50 mL 0.2 mol·L-1的NaCl溶液中Na+的物質(zhì)的量濃度為0.2 mol/L,A符合題意;100 mL 0.1 mol·L-1的Na3PO4溶液中Na+的物質(zhì)的量濃度為0.3 mol/L,B不符合題意;25 mL 0.2 mol·L-1的Na2SO4溶液中Na+的物質(zhì)的量濃度為0.4 mol/L,C不符合題意;10 mL 0.5 mol·L-1的Na2CO3溶液中Na+的物質(zhì)的量濃度為1 mol/L,D不符合題意。
√
6.鉛筆芯主要成分是石墨和黏土。假設(shè)鉛筆芯質(zhì)量的一半是石墨(其余組成物質(zhì)中不含碳),用鉛筆寫一個(gè)漢字消耗的質(zhì)量約為1 mg,那么這個(gè)漢字中含有的碳原子數(shù)約為
A.2.5×1019 B.2.5×1022
C.5×1019 D.5×1022
√
7.(2023·河南偃師高一統(tǒng)考)若CH4與O2按質(zhì)量比1∶4混合時(shí)極易爆炸,此時(shí)CH4與O2的體積比為
A.1∶4 B.1∶2
C.1∶1 D.2∶1
CH4與O2的質(zhì)量比為1∶4,CH4與O2的摩爾質(zhì)量比為1∶2,n= ,因此,CH4與O2的物質(zhì)的量比為1∶2,相同條件下,體積之比等于物質(zhì)的量之比等于1∶2。
√
8.下列敘述正確的是
A.金屬鈉長期置于空氣中,最后變?yōu)镹aOH
B.“84”消毒液可用作漂白劑,過氧化鈉可用作供氧劑
C.Na的金屬活動(dòng)性比Cu強(qiáng),可用Na與CuCl2溶液反應(yīng)制得Cu
D.常溫下,稱取5.9 g NaCl溶于100 mL水配成1 mol·L-1的溶液
金屬鈉會(huì)被空氣中的氧氣氧化生成Na2O,Na2O和空氣中的水反應(yīng)生成NaOH,NaOH和CO2反應(yīng)生成Na2CO3,因此金屬鈉長期置于空氣中,最后變?yōu)镹a2CO3,A項(xiàng)錯(cuò)誤;“84”消毒液中含有NaClO,具有強(qiáng)氧化性,可用作漂白劑,過氧化鈉和水或二氧化碳反應(yīng)生成氧氣,因此過氧化鈉可用作供氧劑,B項(xiàng)正確;Na的金屬活動(dòng)性比Cu強(qiáng),將Na加入到CuCl2溶液中,Na先與水反應(yīng)生成NaOH和H2,NaOH和CuCl2反應(yīng)生成Cu(OH)2藍(lán)色沉淀,無法制得Cu,C項(xiàng)錯(cuò)誤;溶劑的體積不等于溶液的體積,應(yīng)配成100 mL溶液,D項(xiàng)錯(cuò)誤。
√
9.某工業(yè)廢氣所含氮氧化物(NOx)的氮氧質(zhì)量比約為7∶4,該NOx可表
示為
A.N2O B.NO
C.N2O3 D.NO2
根據(jù)氮氧質(zhì)量比14∶16x=7∶4,解得x= ,故氮氧原子個(gè)數(shù)比為2∶1。
A項(xiàng),新制氯水中的HClO見光分解生成氧氣,不符合題意;B項(xiàng),新制氯水中的H+與發(fā)酵粉中的NaHCO3反應(yīng)生成CO2,不符合題意;C項(xiàng),新制氯水中的Cl2與NaBr反應(yīng)生成Br2和NaCl,沒有氣體產(chǎn)生,符合題意;D項(xiàng),H2O與Na2O2反應(yīng)生成O2,不符合題意。
10.(2023·江西高安高一段考)下列實(shí)驗(yàn)過程中,不會(huì)產(chǎn)生氣體的是
√
11.屠呦呦因發(fā)現(xiàn)青蒿素治療瘧疾的新療法而獲得諾貝爾生理學(xué)或醫(yī)學(xué)獎(jiǎng),青蒿素的分子式為C15H22O5,相對(duì)分子質(zhì)量是282。下列關(guān)于青蒿素的說法正確的是
A.C15H22O5的摩爾質(zhì)量為282 g
B.1個(gè)C15H22O5分子的質(zhì)量約為 g
C.1 mol C15H22O5完全燃燒生成22 mol H2O
D.含有6.02×1023個(gè)碳原子的C15H22O5的物質(zhì)的量為1 mol
√
常溫常壓Vm大于22.4 L/mol,22.4 L SO2的物質(zhì)的量小于1 mol,故A錯(cuò)誤;標(biāo)準(zhǔn)狀況下水是液體,不能使用氣體摩爾體積,故B錯(cuò)誤;標(biāo)準(zhǔn)狀況下,44.8 L CO2含有的分子數(shù)為2NA,故C正確;氣體狀況未知,應(yīng)該是標(biāo)準(zhǔn)狀況下1 mol任何氣體的體積都約是22.4 L,故D錯(cuò)誤。
12.(2023·山東青州高一月考)設(shè)NA表示阿伏加德羅常數(shù)的值,下列說法正確的是
A.常溫常壓下,22.4 L SO2的物質(zhì)的量是1 mol
B.標(biāo)準(zhǔn)狀況下,11.2 L H2O的物質(zhì)的量是0.5 mol
C.標(biāo)準(zhǔn)狀況下,44.8 L CO2含有的分子數(shù)為2NA
D.1 mol任何氣體的體積都約是22.4 L
√
13.(2023·安徽桐城高一統(tǒng)考)如圖所示:若關(guān)閉Ⅰ閥,打開Ⅱ閥,讓氯氣經(jīng)過甲瓶后,再通入乙瓶,布條不褪色;若關(guān)閉Ⅱ閥,打開Ⅰ閥,再通入這種氣體,布條褪色。甲瓶中所盛的試劑不可能是
A.濃H2SO4 B.濃NaOH溶液
C.KI溶液 D.飽和NaCl溶液
√
關(guān)閉Ⅰ閥,打開Ⅱ閥,讓氯氣經(jīng)過甲瓶后再通入乙瓶,布條不褪色,可知甲中液體可干燥氯氣或吸收氯氣。濃硫酸能干燥氯氣,干燥的氯氣不具有漂白性,所以乙中紅色布條不褪色,A不符合題意;濃氫氧化鈉溶液與氯氣發(fā)生反應(yīng),消耗掉了氯氣,氯氣無法到達(dá)乙瓶,B不符合題意;KI溶液與Cl2反應(yīng)產(chǎn)生KCl與I2,消耗掉了氯氣,氯氣無法到達(dá)乙瓶,C不符合題意;飽和氯化鈉溶液抑制氯氣的溶解,潮濕的氯氣到達(dá)乙瓶后,可以使紅色布條褪色,D符合題意。
14.(2023·湖北松滋高一期末)氯元素的化合價(jià)與其形成的常見物質(zhì)種類的關(guān)系如圖所示。
下列說法不正確的是
A.b只有還原性
B.c沒有漂白性,d具有漂白性
C.一定條件下e和f均屬于較強(qiáng)氧化劑
D.g的化學(xué)式為HClO4
√
b為HCl,其中+1價(jià)的H化合價(jià)能降低,具有氧化性,A項(xiàng)錯(cuò)誤;c為Cl2,沒有漂白性,d為HClO,具有漂白性,B項(xiàng)正確;e為ClO2,f含ClO,一定條件下二者均屬于較強(qiáng)氧化劑,C項(xiàng)正確;g的化學(xué)式為HClO4,D項(xiàng)正確。
15.(15分)如圖為氯及其化合物的“價(jià)—類”二維圖。
(1)填寫二維圖缺失的類別A 和B的化學(xué)式 。
(2)某同學(xué)利用以下試劑研究HCl的性質(zhì),進(jìn)行了如下預(yù)測:
a.NaClO b.Fe c.NaOH d.KMnO4 e.AgNO3
從物質(zhì)類別上看,HCl屬于 ,可能與 (填字母,下同)發(fā)生反應(yīng);
從化合價(jià)角度看,Cl-具有 性,可能與 發(fā)生反應(yīng)。
單質(zhì)
HClO
酸
abce
ad
還原
(3)某工廠用NaCl溶液制備氯氣,其化學(xué)原理為如下反應(yīng):
H2O+ NaCl Cl2↑+ NaOH+ ____________________
______________
①請(qǐng)將上述化學(xué)方程式補(bǔ)充完整,并用單線橋表示電子轉(zhuǎn)移的方向和數(shù)目。
②反應(yīng)中NaCl做 劑,理由是 __________________________________
_________________。
還原
反應(yīng)中氯元素由-1價(jià)上升為0價(jià)(或Cl-
在反應(yīng)中失去電子)
Cl2↑+
2NaOH+H2↑
16.(16分)金屬及其化合物的種類很多,我們可以按照“金屬單質(zhì)、金屬氧化物、金屬氫氧化物、鹽”的類別進(jìn)行研究。以下是核電荷數(shù)小于18的某種金屬元素對(duì)應(yīng)的單質(zhì)及其化合物之間的轉(zhuǎn)化關(guān)系(“→”所指的轉(zhuǎn)化都是一步完成)。其中B為呼吸面具中的供氧劑。
(1)A元素原子結(jié)構(gòu)示意圖為 。
(2)B供氧時(shí)每生成1 mol O2,反應(yīng)過程中轉(zhuǎn)移的電子數(shù)為 ,A與水反應(yīng)的離子方程式為 。
(3)200 ℃時(shí),11.6 g CO2和H2O的混合物氣體與足量的B反應(yīng),反應(yīng)后固體增加了3.6 g,則原混合物的平均相對(duì)分子質(zhì)量為 。
(4)寫出一種“C→D”轉(zhuǎn)化的離子方程式: 。
2NA
2Na+2H2O===2Na++2OH-+H2↑
23.2
OH-+H+===H2O(合理即可)
(5)某同學(xué)將一小塊A單質(zhì)露置于空氣中,觀察到下列現(xiàn)象:
則下列說法正確的是 (填字母)。
A.①發(fā)生了氧化還原反應(yīng)
B.①變灰暗色是因?yàn)樯闪诉^氧化鈉
C.③是碳酸鈉吸收空氣中的水蒸氣形成了溶液
D.④只發(fā)生物理變化
A
17.(15分)二氧化氯(ClO2)是一種優(yōu)良的消毒劑,熔點(diǎn)為-59 ℃,沸點(diǎn)為 11 ℃,濃度過高時(shí)易發(fā)生分解,甚至爆炸。某課外興趣小組通過氯氣與 NaClO2溶液反應(yīng)來制取少量ClO2,裝置如圖所示:
(1)甲裝置中圓底燒瓶內(nèi)發(fā)生反應(yīng)的化學(xué)方程式是_______________________
_____________________,其中HCl表現(xiàn)了 。
MnCl2+Cl2↑+2H2O
酸性和還原性
丙裝置中氯氣先和水反應(yīng),反應(yīng)的化學(xué)方程式為Cl2+H2O HCl+HClO。
(2)丙裝置中發(fā)生的反應(yīng)可能經(jīng)兩步完成,請(qǐng)將其補(bǔ)充完整:
①____________________________(用化學(xué)方程式表示)。
②HClO+HCl+2NaClO2===2ClO2↑+2NaCl+H2O。
Cl2+H2O
HCl+HClO
從甲裝置中出來的氯氣中混有氯化氫,氯氣在飽和食鹽水中不溶,氯化氫溶解在水中,故乙裝置中試劑瓶內(nèi)的液體是飽和食鹽水;通入適量的N2稀釋ClO2,其目的是防止ClO2發(fā)生分解,甚至爆炸。
(3)Cl-存在時(shí)會(huì)催化ClO2的生成,若無乙裝置,則丙裝置內(nèi)產(chǎn)生ClO2的速率明顯加快。乙裝置中試劑瓶內(nèi)的液體是 。實(shí)驗(yàn)過程中常需通入適量的N2稀釋ClO2,其目的是 。
飽和食鹽水
防止ClO2發(fā)生分解,甚至爆炸
(4)戊裝置燒杯中NaOH溶液吸收ClO2后,生成了ClO 、ClO ,該反應(yīng)的離子方程式是 。
18.(12分)如圖為實(shí)驗(yàn)室某濃鹽酸試劑瓶上的標(biāo)簽的有關(guān)內(nèi)容,試根據(jù)標(biāo)簽上的有關(guān)數(shù)據(jù)回答下列問題:
鹽酸
分子式:HCl
相對(duì)分子質(zhì)量:36.5
密度:1.19 g·cm-3
HCl的質(zhì)量分?jǐn)?shù):36.5%
(1)該濃鹽酸中HCl的物質(zhì)的量濃度為 mol·L-1。
11.9
溶液的濃度和密度不隨所取量的多少而變化。
(2)取用任意體積的該鹽酸時(shí),下列物理量中不隨所取體積的多少而變化的是 (填字母)。
A.溶液中HCl的物質(zhì)的量
B.溶液的濃度
C.溶液中Cl-的數(shù)目
D.溶液的密度
BD
鹽酸
分子式:HCl
相對(duì)分子質(zhì)量:36.5
密度:1.19 g·cm-3
HCl的質(zhì)量分?jǐn)?shù):36.5%
(3)某學(xué)生欲用上述濃鹽酸和蒸餾水配制500
mL物質(zhì)的量濃度為0.400 mol·L-1的稀鹽酸。
①該學(xué)生需要量取 mL上述濃鹽酸進(jìn)
行配制。
16.8
鹽酸
分子式:HCl
相對(duì)分子質(zhì)量:36.5
密度:1.19 g·cm-3
HCl的質(zhì)量分?jǐn)?shù):36.5%
②在配制過程中,下列實(shí)驗(yàn)操作對(duì)所配制的稀鹽酸的物質(zhì)的量濃度有何影響?(在括號(hào)內(nèi)填A(yù)表示“偏大”,填B表示“偏小”,填C表示“無
影響”)
a.用量筒量取濃鹽酸時(shí)俯視觀察凹液面。
b.定容后經(jīng)振蕩、搖勻、靜置,發(fā)現(xiàn)液面下降,再加適量的蒸餾水。
c.定容搖勻后,發(fā)現(xiàn)液面低于刻度線,未做任何處理。
d.定容時(shí),俯視刻度線。
( )
( )
( )
( )
B
B
C
A
鹽酸
分子式:HCl
相對(duì)分子質(zhì)量:36.5
密度:1.19 g·cm-3
HCl的質(zhì)量分?jǐn)?shù):36.5%
返回
展開更多......
收起↑
 資源預(yù)覽
資源預(yù)覽