資源簡介
資源簡介
第19講 化學鍵
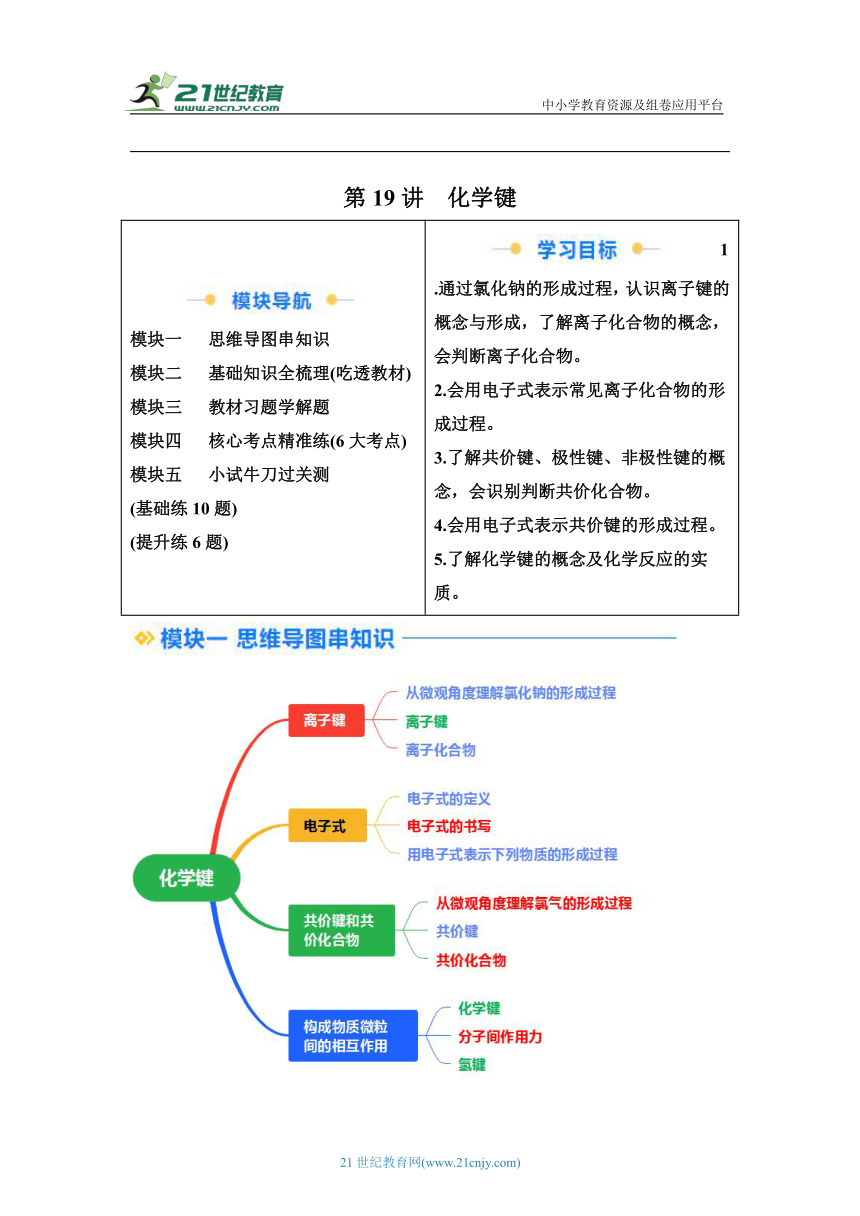
模塊一 思維導圖串知識 模塊二 基礎知識全梳理(吃透教材) 模塊三 教材習題學解題 模塊四 核心考點精準練(6大考點) 模塊五 小試牛刀過關測 (基礎練10題) (提升練6題) 1.通過氯化鈉的形成過程,認識離子鍵的概念與形成,了解離子化合物的概念,會判斷離子化合物。 2.會用電子式表示常見離子化合物的形成過程。 3.了解共價鍵、極性鍵、非極性鍵的概念,會識別判斷共價化合物。 4.會用電子式表示共價鍵的形成過程。 5.了解化學鍵的概念及化學反應的實質。
一、離子鍵
1.從微觀角度理解氯化鈉的形成過程
不穩定的鈉原子和氯原子通過得失電子后最外層都達到8電子穩定結構,分別形成Na+和Cl-,帶相反電荷的Na+和Cl-通過靜電作用結合在一起,形成新物質氯化鈉。
2.離子鍵
3.離子化合物
【特別提醒】
(1)活潑金屬元素[如第ⅠA族(Na、K),第ⅡA族(Ca、Mg)]與活潑非金屬元素[如第ⅥA族(O、S),第ⅦA族(F、Cl)]之間易形成離子鍵。
(2)并不是所有的金屬與非金屬化合都能形成離子鍵,如AlCl3中不存在離子鍵。
(3)非金屬元素也可形成離子鍵,如NH4Cl中,NH與Cl-間的化學鍵就是離子鍵。
(4)離子化合物一定含有離子鍵,含離子鍵的化合物一定是離子化合物。
二、電子式
1.定義
在元素符號周圍用“·”或“×”來表示原子的最外層電子(價電子)的式子叫做電子式。
2.書寫
(1)原子的電子式
元素符號周圍標明元素原子的最外層電子,每個方向不能超過2個電子。當最外層電子數小于或等于4時以單電子分布,多于4時多出部分以電子對分布。例如:
鎂原子:;碳原子:;
氧原子:;氖原子:。
(2)簡單陽離子的電子式
簡單陽離子是由金屬原子失電子形成的,原子的最外層已無電子,故用陽離子的符號表示,例如:Na+、Li+、Mg2+、Al3+等。
(3)簡單陰離子的電子式
不但要畫出最外層電子數,而且還應用“[ ]”括起來,并在右上角標出“n-”以表示其所帶的電荷。例如:
氯離子:、硫離子:。
(4)離子化合物的電子式
氧化鈣:、硫化鉀:。
提示 相同離子不合并,分列在另一離子的周圍。
3.用電子式表示下列物質的形成過程
(1)NaCl:。
(2)MgBr2:。
【歸納總結】書寫電子式的注意事項
(1)一個“·”或“×”代表一個電子,原子的電子式中“·”(或“×”)的個數即原子的最外層電子數。
(2)同一原子的電子式不能既用“×”又用“·”表示。
(3)“[ ]”在所有的陰離子、復雜的陽離子中出現。
(4)在化合物中,如果有多個陰、陽離子,陰、陽離子必須是間隔的,即不能將兩個陰離子或兩個陽離子寫在一起,如CaF2要寫成,不能寫成,也不能寫成。
(5)用電子式表示化合物形成過程時,由于不是化學方程式,不能出現“=”。“→”前是原子的電子式,“→”后是化合物的電子式。
三、共價鍵和共價化合物
1.從微觀角度理解氯氣的形成過程
→
→→
請你根據上述圖示,用電子式表示其形成過程:。
2.共價鍵
(1)概念:原子間通過共用電子對所形成的相互作用。
(2)成鍵三要素
①成鍵微粒:原子。
②成鍵元素:一般是同種的或不同種的非金屬元素。
③成鍵條件:成鍵前原子最外層電子未達到飽和狀態。
(3)分類
3.共價化合物
四、共價分子結構的表示方法
1.常見單質的電子式與結構式
在化學上,常用一根短線“—”表示1對共用電子的圖示叫做結構式。
分子 H2 N2 Cl2
電子式
結構式 H—H N≡N Cl—Cl
2.常見化合物的電子式、結構式和空間結構
分子 H2O CO2 CH4
電子式
結構式 O=C=O
空間結構 V形 直線形 正四面體形
五、構成物質微粒間的相互作用
1.化學鍵
2.分子間作用力
(1)分子間存在一種把分子聚集在一起的作用力,叫做分子間作用力,又稱范德華力。
(2)由分子構成的物質,其熔、沸點等物理性質主要由分子間作用力大小決定。
3.氫鍵
(1)氫鍵不是化學鍵,通常把氫鍵看作是一種特殊的分子間作用力。氫鍵比化學鍵弱,比范德華力強。
(2)分子間形成的氫鍵會使物質的熔點和沸點升高,水分子間的氫鍵可使其密度在固態時低于液態時的密度。
4.化學反應的過程
化學反應的過程,本質上就是舊化學鍵斷裂和新化學鍵形成的過程。H2和Cl2反應生成HCl可用如下過程表示:
教材習題01
1.Y元素最高正價與最低負價的絕對值之差是4;Y元素與M元素形成離子化合物,并在水中電離出電子層結構相同的離子,該化合物是( )
A.KCl B.Na2S C.Na2O D.K2S
教材習題02
2.下列說法正確的是。
A.離子鍵就是陰陽離子間的靜電引力
B.所有金屬元素與所有非金屬元素間都能形成離子鍵
C.鈉原子與氯原子結合成氯化鈉后體系能量降低
D.在離子化合物CaCl2中,兩個氯離子間也存在離子鍵
教材習題03
3.下列說法錯誤的是( )
A.含有共價鍵的化合物一定是共價化合物
B.在共價化合物中一定含有共價鍵
C.構成單質分子的微粒不一定含有共價鍵
D.雙原子單質分子中的共價鍵一定是非極性鍵
核心考點一:離子鍵與離子化合物
【例1】
4.下列說法正確的是
A.陰、陽離子通過靜電吸引形成的強烈相互作用稱為離子鍵
B.第ⅠA族元素原子和第ⅦA族元素原子之間都形成離子鍵
C.元素周期表中第一周期元素間不能形成離子鍵
D.元素周期表中第ⅠA族元素間不可能形成離子鍵
核心考點二:電子式
【例2】
5.下列化合物電子式書寫正確的是
A. B.
C. D.
核心考點三:電子式表示物質的形成過程
【例3】
6.下列用電子式表示物質的形成過程,正確的是
A.
B.
C.
D.
核心考點四:共價鍵與共價化合物
【例4】
7.下列各組物質中,都含有共價鍵,卻又都不屬于共價化合物的一組( )
A.Na2O2 Na2O B.KClO NaOH C.Br2 HBr D.HF H2O
核心考點五:構成物質微粒間的相互作用
【例5】
8.下列關于化學鍵的說法正確的是
A.兩個原子之間的相互作用叫做化學鍵
B.并不是所有物質中都一定含有化學鍵
C.非極性鍵只存在于雙原子單質分子中
D.化學鍵分為離子鍵、共價鍵、極性鍵和非極性鍵四種
核心考點六:化學鍵與物質類別
【例6】
9.下列有關化學鍵的說法中正確的是
A.碘晶體升華和冰熔化時都涉及化學鍵的變化
B.氯化鈉熔化或氯化氫溶于水時都要破壞化學鍵
C.離子化合物中可能含有共價鍵,共價化合物中可能含有離子鍵
D.氯化銨受熱變成氣體,冷卻后又成晶體,此過程中化學鍵沒有發生變化
核心考點七:元素推斷與化學鍵的綜合考查
【例7】
10.短周期元素X、Y、Z所在的周期數依次增大,它們的原子序數之和為20,且Y2-與Z+核外電子層的結構相同。下列化合物中同時存在極性和非極性共價鍵的是
A.Z2Y B.X2Y2 C.Z2Y2 D.ZYX
【基礎練】
11.下列關于離子鍵和離子化合物的說法正確的是
A.離子鍵是指帶相反電荷的陰、陽離子之間的相互吸引作用
B.離子鍵只能在活潑金屬和活潑非金屬元素原子之間形成
C.離子鍵的作用僅僅局限于相鄰的兩個陰、陽離子之間
D.CaO、NaCl、NaOH中均存在離子鍵,都是離子化合物
12.下列有關物質的電子式錯誤的是
A.H∶Cl B. C. D.
13.下列物質中,只有含極性共價鍵的是
A.單質碘 B.氫氧化鈉 C.水 D.氯化銨
14.下列關于化學鍵的說法正確的是
A.有化學鍵斷裂的變化一定是化學變化
B.中含有極性鍵和非極性鍵
C.受熱分解既破壞了離子鍵,又破壞了極性共價鍵
D.共價化合物中不可能含有金屬元素
15.下列說法正確的有
A.強酸都是離子化合物
B.共價化合物一定不含離子鍵
C.離子化合物中一定含有金屬元素
D.含有金屬元素的一定是離子化合物
16.下列說法正確的有
A.硫酸氫鈉晶體加熱至熔融態破壞了離子鍵
B.干冰升華破壞了共價鍵
C.冰融化破壞了氫鍵和離子鍵
D.氯化氫溶于水破壞了離子鍵
17.下列只含共價鍵的化合物是
A.HClO4 B.NaCl C.KOH D.MgCl2
18.下列有關化學用語的表示方法中正確的是
A.次氯酸的電子式:
B.Na+的結構示意圖:
C.用電子式表示MgCl2的形成過程:
D.M2+核外有a個電子,b個中子,M的原子符號為:
19.下列物質中,既有離子鍵,又含有共價鍵的是
A.NaClO B.BaCl2 C.CH3COOH D.SiO2
20.下列敘述中正確的是
A.含離子鍵的化合物一定是離子化合物
B.含共價鍵的化合物一定是共價化合物
C.全部由非金屬元素組成的化合物一定是共價化合物
D.在離子化合物中不可能有共價鍵
【提升練】
21.W、X、Y、Z為原子序數依次增大的短周期主族元素,W、X、Y三種元素原子的最外層電子數之和為11;W、X同周期且相鄰,W的最外層電子數為4,的M層有8個電子。下列結論正確的是
A.X、Y、Z離子半徑的大小順序為Z>Y>X
B.Y與Z形成的化合物為共價化合物
C.最高價氧化物對應的水化物的酸性:Z
22.下列敘述正確的是
①用電子式表示的形成過程為:
②兩個不同種非金屬元素的原子間形成的化學鍵都是極性鍵
③離子化合物在熔融狀態時能夠導電
④含有非極性鍵的化合物一定是共價化合物
⑤元素周期表中位于金屬和非金屬分界線附近的元素屬于過渡元素
⑥次氯酸的電子式:
⑦離子化合物中一定含有離子鍵
A.①②③④⑥⑦ B.①②③⑤⑦ C.②③⑦ D.全部
23.短周期主族元素W、X、Y、Z、Q原子序數依次增大,形成的化合物是一種重要的食品添加劑,結構如下圖。Z核外最外層電子數與X核外電子總數相等。W的原子半徑在周期表中最小。下列有關敘述正確的是
A.原子半徑大小:Q>Z>Y
B.該化合物中Y原子不滿足8電子穩定結構
C.該化合物中,W、X、Y、Z、Q之間均為共價鍵
D.Q元素對應的單質能與水反應
24.隨原子序數的遞增,八種短周期元素的原子半徑、最高正價或最低負價的變化如圖所示。
下列敘述正確的是
A.離子半徑的大小順序:d
C.x、z、d組成的化合物一定是共價化合物
D.h、g對應的陰離子還原性:h
A.中只存在極性共價鍵
B.B、X兩元素至少可以形成兩種化合物
C.的離子半徑小于
D.B和Z的氧化物對應水化物的酸性:B
(1)填表,完成下列表格
微粒名稱 微粒結構示意圖 電子式
硫離子
氬原子
鎂離子
(2)某微粒的結構示意圖可表示為。
①當x=10+y時,該粒子為 (填“原子”“正離子”或“負離子”),當x<10+y時,該粒子為 。
②當y=8時,若該微粒帶有一個單位負電荷,則x= ,該微粒的離子符號為 。
③當y=5時,若該微粒為中性原子R,其質量數為31,則中含有的中子數為 。
中小學教育資源及組卷應用平臺
試卷第1頁,共3頁
21世紀教育網(www.21cnjy.com)
參考答案:
1.D
【詳解】由信息“Y元素最高正價與最低負價的絕對值之差是4”,可確定Y元素位于第ⅥA族;
A.Cl是第ⅥIA族元素,故A不符合題意;
B.鈉離子和硫離子核外電子層不相同,故B不符合題意;
C.氧不存在最高正價,不符合元素最高正價與最低負價的絕對值之差是4,故C不符合題意;
D.K2S電離出的K+與S2-具有相同的電子層結構,故D符合題意;
故選:D。
2.C
【詳解】A.形成離子鍵時除陰、陽離子之間有靜電吸引作用外,還存在電子與電子、原子核與原子核之間的排斥作用,A項錯誤;
B.金屬與非金屬之間可形成離子鍵,也可形成共價鍵,B項錯誤;
C.鈉離子和氯離子形成氯化鈉釋放能量,體系能量降低,正確;
D.離子鍵一定是陰、陽離子之間形成的,不可能是陽離子與陽離子或陰離子與陰離子之間形成的,D項錯誤。
3.A
【詳解】A.含有共價鍵的化合物不一定是共價化合物,如NaOH、銨鹽等,它們含有共價鍵,但它們是離子化合物,故A錯誤;
B.共價化合物中一定含有共價鍵,故B正確;
C.構成單質分子的微粒不一定含有共價鍵,如稀有氣體的分子是單原子分子,不含有共價鍵,故C正確;
D.雙原子單質分子形成的共價鍵,因為原子相同得失電子能力相等,共用電子對不發生偏移,一定是非極性鍵,故D正確;
故選A。
【點睛】含有離子鍵的化合物一定是離子化合物,但含有共價鍵的化合物不一定是共價化合物,例如銨鹽等。
4.C
【詳解】A.陰、陽離子通過靜電作用所形成的強烈相互作用稱為離子鍵,靜電作用包括靜電吸引和靜電排斥兩種作用,A錯誤;
B.第ⅠA族元素包括H和堿金屬元素,H元素的原子和第ⅦA族元素原子之間通過共價鍵結合形成共價化合物,如HCl分子中存在共價鍵;而Na等堿金屬與第ⅦA族元素原子之間通過電子得失形成陰、陽離子,離子之間通過離子鍵結合形成離子化合物,B錯誤;
C.元素周期表中第一周期元素包括H、He,H原子與He原子之間不能形成離子鍵,C正確;
D.元素周期表中第ⅠA族元素間可能形成離子鍵,如NaH為離子化合物,Na+與H-之間通過離子鍵結合形成離子化合物,D錯誤;
故合理選項是C。
5.A
【詳解】A.KF是離子化合物,K+和F-形成離子鍵,其電子式為,A選項正確;
B.Na2S是離子化合物,Na+和S2-形成離子鍵,其正確的電子式為,B選項錯誤;
C.MgO是離子化合物,Mg2+和O2-形成離子鍵,其正確的電子式為,C選項錯誤;
D.CaCl2是離子化合物,Ca2+和Cl-形成離子鍵,其正確的電子式為,D選項錯誤;
答案選A。
6.D
【詳解】A.氯化氫是共價化合物,沒有陰陽離子 ,故A錯誤;
B.溴化鈉是離子化合物,電子式應該有陰陽離子 ,故B錯誤;
C.離子化合物的電子式相同離子需要合并,故C錯誤;
D. 符合電子式的書寫原則,故D正確;
故選:D。
7.B
【詳解】A、Na2O2、Na2O都屬于離子化合物,但氧化鈉只有離子鍵,A不符合題意;
B、次氯酸鉀和氫氧化鈉均是離子化合物,均含有離子鍵和共價鍵,B符合題意;
C、溴和溴化氫均只含有共價鍵,溴是單質,HBr是共價化合物,C不符合題意;
D、HF和H2O均是只含有共價鍵的共價化合物,D不符合題意;
答案選B。
8.B
【詳解】A.化學鍵通常是指相鄰原子之間強烈的相互作用,故A錯誤;
B.惰性氣體中不存在化學鍵,故B正確;
C.過氧化氫等物質中也存在非極性共價鍵,故C錯誤;
D.極性鍵和非極性鍵均屬于共價鍵,故D錯誤;
選B。
9.B
【詳解】A.碘晶體、冰為分子晶體,則碘晶體升華、冰熔化時都破壞分子間作用力,所以A錯誤;
B.氯化鈉熔化破壞離子鍵,HCl溶于水破壞共價鍵,所以B選項是正確的;
C.離子化合物中可能含有共價鍵,如NaOH,但共價化合物中一定不含有離子鍵,所以C選項錯誤;
D.氯化銨受熱變成氣體,冷卻后又成晶體,發生了化學變化,一定有化學鍵的斷裂和生成,所以D錯誤;
【點睛】A. 碘晶體、冰為分子晶體;B. 電解質電離時破壞化學鍵;C含離子鍵的化合物為離子化合物,離子化合物中可能含共價鍵; D.氯化銨受熱變成氣體,發生了化學變化。
10.B
【詳解】Y2-與Z+核外電子層的結構相同,因此Y是第ⅥA,Z是第IA。又因為短周期元素X、Y、Z所在的周期數依次增大,即它們分別屬于第一周期、第二周期和第三周期,則Y是O,Z是Na。由于它們的原子序數之和為20,所以X是H。
A.Na2O,由氧離子和鈉離子構成,只含有離子鍵,A項錯誤;
B.H2O2,結構式為H-O-O-H,H和O之間存在極性鍵,O和O之間是非極性鍵,B項正確;
C.Na2O2,由鈉離子和過氧根組成,離子鍵存在離子鍵,過氧根中O和O之間存在非極性鍵,C項錯誤;
D.NaOH,由鈉離子和氫氧根構成,離子鍵存在離子鍵,氫氧根中O和H之間存在極性鍵,D項錯誤;
答案是B。
11.D
【詳解】A.離子鍵是指陰、陽離子之間的靜電作用,包括引力和斥力,A錯誤;
B.不是只有活潑的金屬元素和活潑的非金屬元素之間才能形成離子鍵,如銨離子與氯離子也能形成離子鍵,B錯誤;
C.離子鍵的作用不僅局限于相鄰的兩個陰、陽離子之間,還存在于原子核和電子之間,C錯誤;
D.CaO、NaCl、NaOH都是由活潑金屬陽離子與陰離子構成的,均存在離子鍵,都是離子化合物,D正確;
故答案為:D。
12.A
【詳解】
A.HCl屬于共價化合物,氫原子和氯原子共用1對電子,氯原子最外層符合8電子穩定結構,電子式是,故A錯誤;
B.NaOH是離子化合物,鈉離子和氫氧根離子存在離子鍵,氫氧根內O與H原子共用1對電子對,電子式為,故B正確;
C.Na2S是離子化合物,鈉離子和硫離子存在離子鍵,電子式為,故C正確;
D.Na2O2中鈉離子和過氧根離子存在離子鍵,過氧根內O與O原子存在共價鍵,電子式為,故D正確;
故選A。
13.C
【詳解】A.單質碘是含有非極性共價鍵的非金屬單質,故A不符合題意;
B.氫氧化鈉是含有離子鍵和極性共價鍵的離子化合物,故B不符合題意;
C.水是只含有極性共價鍵的共價化合物,故C正確;
D.氯化銨是含有離子鍵、極性共價鍵和配位鍵的離子化合物,故D不符合題意;
故選C。
14.C
【詳解】A.既有舊化學鍵的斷裂,又有新化學鍵的生成屬于化學變化;例氯化鈉晶體的熔化只有舊化學鍵的斷裂不屬于化學變化,A錯誤;
B.的結構類似,只含極性鍵,B錯誤;
C.中既含離子鍵,又含極性共價鍵,且受熱分解生成碳酸鈉、水和二氧化碳,C正確;
D.共價化合物中可能含有金屬元素,如,D錯誤;
故選C。
15.B
【詳解】A.酸是由分子組成的共價化合物,A說法錯誤;
B.只含共價鍵的化合物為共價化合物,共價化合物中一定不含離子鍵,B說法正確;
C.離子化合物是由陰離子和陽離子通過離子鍵結合的化合物,不一定含金屬元素,如氯化銨,C說法錯誤;
D.含有金屬元素的化合物不一定是離子化合物,比如氯化鋁含有氯元素,屬于共價化合物,D說法錯誤;
故答案為:B。
16.A
【詳解】A.硫酸氫鈉加熱至熔融態電離出鈉離子和硫酸氫根離子,破壞了離子鍵,共價鍵不變,故A正確;
B.干冰升華是物理變化,不破壞共價鍵,破壞了分子間作用力(范德華力),故B錯誤;
C.冰→水屬于狀態變化,破壞了氫鍵和分子間作用力(范德華力),共價鍵未被破壞,故C錯誤;
D.氯化氫由分子構成,不含離子鍵,氯化氫溶于水破壞了共價鍵,故D錯誤;
故選A。
17.A
【分析】原子間通過共用電子對形成的化學鍵是共價鍵,據此解答。
【詳解】A.HClO4分子中只存在共價鍵,A選;
B.NaCl中只存在離子鍵,B不選;
C.KOH中存在離子鍵和共價鍵,C不選;
D.MgCl2中只存在離子鍵,D不選;
答案選A。
18.D
【詳解】
A.次氯酸的電子式為,A錯誤;
B.Na+的結構示意圖為,B錯誤;
C.用電子式表示MgCl2的形成過程為,C錯誤;
D.M2+核外有a個電子,質子數是a+2,b個中子,質量數為a+b+2,則M的原子符號為:,D正確;
答案選D。
19.A
【詳解】A.NaClO由Na+、ClO-構成,既有離子鍵又有共價鍵,故選A;
B.BaCl2由Ba2+、Cl-構成,只含離子鍵,故不選B;
C.CH3COOH是共價化合物,只含共價鍵,故不選C;
D.SiO2是共價化合物,只含共價鍵,故不選D;
選A。
20.A
【詳解】A.含離子鍵的化合物一定是離子化合物,如NaCl、NaOH均一定含離子鍵,故A正確;
B.含共價鍵的化合物可能為離子化合物,如NaOH、NaClO等,故B錯誤;
C.非金屬元素形成的化合物可能為離子化合物,如銨鹽,故C錯誤;
D.在離子化合物中也可能含有共價鍵和離子鍵,不可能含有金屬鍵,故D錯誤;
答案:A。
21.D
【分析】W、X、Y、Z為原子序數依次增大的短周期主族元素,W、X同周期且相鄰,W、X、Y三種元素原子的最外層電子數之和為11,W的最外層電子數為4,則W為C元素、X為N元素、Y為元素。的M層有8個電子,Z為元素。
【詳解】A.電子層數越多,離子半徑越大;電子層結構相同,質子數越大,離子半徑越小,故離子半徑的大小順序為,A錯誤;
B.是離子化合物,B錯誤;
C.最高價氧化物對應的水化物的酸性:,C錯誤;
D.氯氣是很活潑的非金屬單質,氧化性:,D正確;
故選D。
22.C
【詳解】①用電子式表示MgCl2的形成過程中,電子轉移的箭頭應從Mg指向Cl,①不正確;
②極性鍵是由兩個不同種非金屬元素的原子間所形成,②正確;
③在熔融狀態時,離子化合物中的陰、陽離子能發生自由移動,能夠導電,③正確;
④離子化合物Na2O2中含有氧氧非極性鍵,④不正確;
⑤過渡金屬是指從IIIB到IIB之間的十個縱列元素,并不是元素周期表中位于金屬和非金屬分界線附近的元素,⑤不正確;
⑥次氯酸的電子式為,⑥不正確;
⑦離子化合物中一定含有離子鍵,含離子鍵的化合物一定是離子化合物,⑦正確;
綜合以上分析,只有②③⑦正確,故選C。
23.D
【分析】短周期主族元素W、X、Y、Z、Q原子序數依次增大,W的原子半徑在周期表中最小,則W為H元素;由圖示化合物的結構圖可知,X為第ⅣA族元素,Y為VA族元素,Q為第IA族元素,Z為ⅥA族元素,且Z核外最外層電子數與X核外電子總數相等,結合原子序數大小可知,X為C元素,Y為N元素,Z為O元素,Q為Na元素,以此解答該題。
【詳解】由上述分析可知,W為H、X為C、Y為N、Z為O、Q為Na。則
A.Y為N,Z為O,Q為Na,主族元素同周期從左向右原子半徑逐漸減小,同主族從上到下原子半徑逐漸增大,則原子半徑:Na>N>O,故A錯誤;
B.該化合物中Y原子形成3對共用電子對,Y上有1對孤電子對,Y滿足8電子穩定結構,故B錯誤;
C.該化合物中含有離子鍵,故C錯誤;
D.鈉和水反應生成氫氧化鈉和氫氣,故D正確;
故選D。
24.D
【分析】從圖中的化合價、原子半徑的大小及原子序數,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素,結合對應元素化合物的性質以及元素周期律解答該題。
【詳解】A.d為O、e為Na,f為Al,三種離子具有相同電子層排布,原子序數大的離子半徑小,則簡單離子半徑大小:d>e>f,故A錯誤;
B.d為O、e為Na,組成的化合物Na2O2中含有非極性共價鍵,故B錯誤;
C.x(H)、z(N)和d(O)可形成離子化合物,如硝酸銨,故C錯誤;
D.g是S元素,h是Cl元素,非金屬性S
25.B
【分析】A、B、X、Y、Z是原子序數依次增大的短周期主族元素,常見化合物與水反應生成X的單質,所得溶液可使酚酞溶液變紅,所以Y為Na、X為O,X與Z同主族,則Z為S,A與Y同主族且X與A可形成10電子化合物,則A為H,B與Z的最外層電子數之比為2:3,B與A可形成10電子化合物, 所以B為C,綜上所述,A、B、X、Y、Z分別為:H、C、O、Na、S。
【詳解】A.為H2O2,其中既存在極性共價鍵又存在非極性共價鍵,故A錯誤;
B.C、O 兩元素除了可以形成CO、CO2兩種常見化合物,還可以形成其他化合物,故B正確;
C.與具有相同的電子層結構,核電荷數越大半徑越小,所以的離子半徑大于,故C錯誤;
D.C的非金屬性弱于S,所以C的最高價的氧化物對應水化物的酸性弱于S 的,但題中沒有交代價態,故D錯誤;
故答案為:B。
26.(1) Mg2+
(2) 原子 負離子 17 Cl- 48
【詳解】(1)
①②硫離子的結構示意圖為,電子式為;
③④氬原子的結構示意圖,電子式為;
⑤⑥鎂離子的結構示意圖為,電子式為Mg2+;
(2)根據結構示意圖可知,該微粒可以是原子或者離子,據此回答:
①當x=10+y時,該粒子原子;
②當x<10+y時,該粒子為負離子;
③當y=8時,若該微粒帶有一個單位負電荷,為氯離子,則x=17;④離子符號為Cl-;
⑤當y=5時,若該微粒為中性原子P,其質量數為31,中子數為16,則微粒的中子數,48.
答案第1頁,共2頁
答案第1頁,共2頁
展開更多......
收起↑
 資源預覽
資源預覽