 資源預(yù)覽
資源預(yù)覽
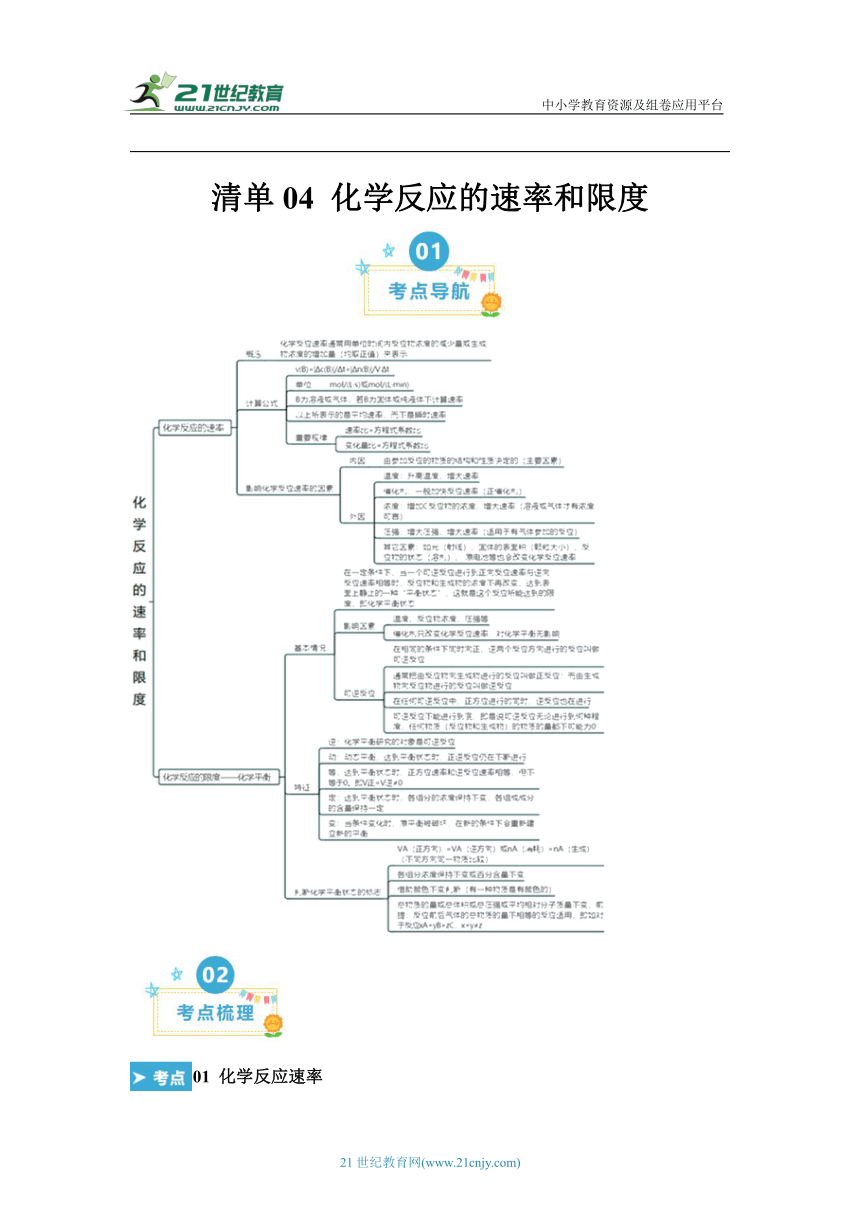
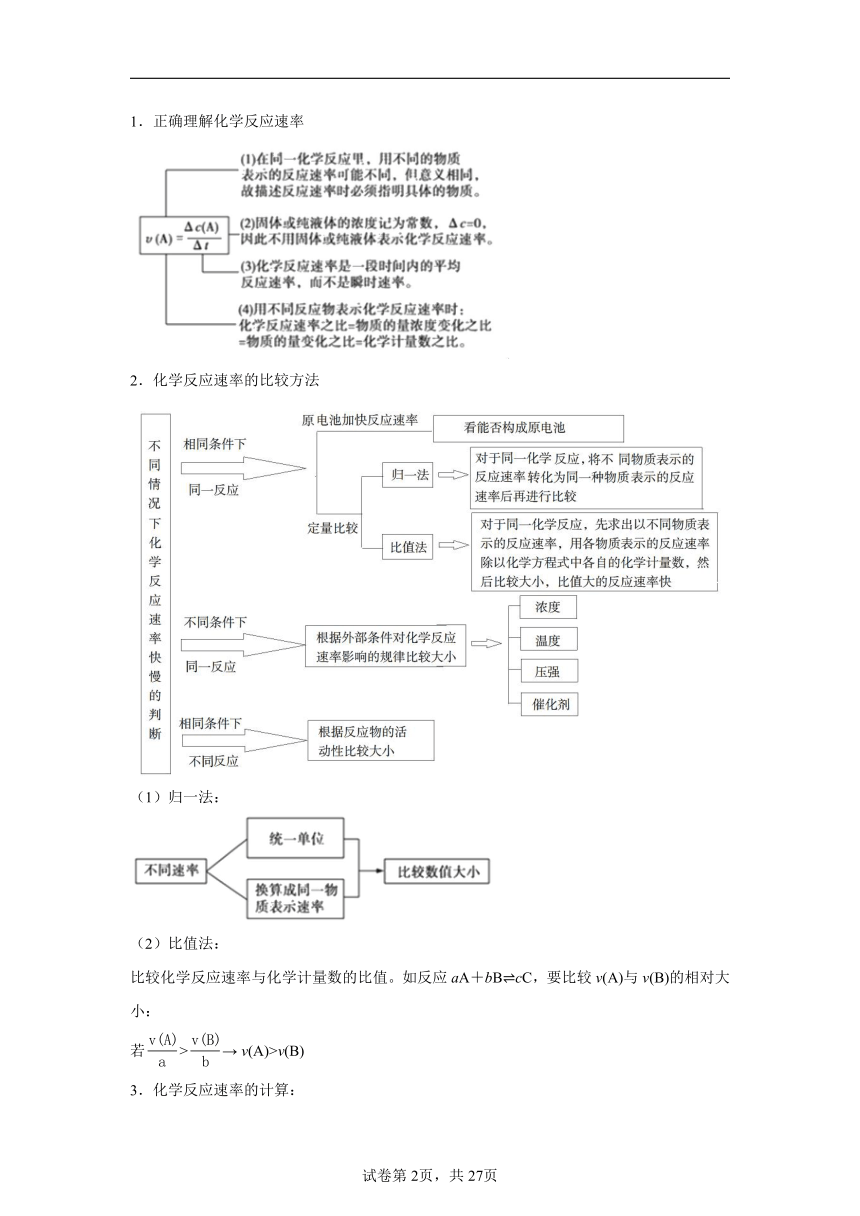



 資源預(yù)覽
資源預(yù)覽




