資源簡介
資源簡介
第三章 烴的衍生物—高二化學人教版(2019)期末復習知識大盤點
第一部分:學習目標整合
1.了解一些簡單鹵代烴的主要物理性質。能列舉溴乙烷的物理性質,能描述和分析溴乙烷的重要反應,并書寫相應的化學方程式。能分析和推斷其他鹵代烴的化學性質,并根據有關信息書寫相應的化學方程式。
2.能列舉一些簡單醇的主要物理性質。能根據醇羥基的結構特點,描述和分析乙醇的重要反應,并書寫相應的化學方程式。能分析和推斷其他醇的化學性質,并根據有關信息書寫相應的化學方程式。能根據酚羥基的結構特點,描述和分析苯酚的重要反應,并書寫相應的化學方程式。
3.能寫出醛基和乙醛的結構簡式,能列舉乙醛的物理性質。能根據醛基的結構特點描述和分析乙醛的重要反應,并書寫相應的化學方程式。能分析和推斷其他醛的化學性質,并根據有關信息書寫相應的化學方程式。
4.能列舉一些簡單羧酸的主要物理性質。能根據羧基的結構特點描述和分析羧酸的重要反應,并書寫相應的化學方程式。能描述和分析酯的重要反應,能描述油脂的重要反應,并書寫相應的化學方程式。
5.能綜合應用有關知識完成推斷有機化合物、檢驗官能團、設計有機合成路線等任務。
第二部分:教材習題變式
1.下列說法正確的是( )
A.所有的鹵代烴都能發生消去反應
B.向混有苯酚的苯中加入濃溴水,過濾,可除去其中的苯酚
C.消去反應是引入碳碳雙鍵的唯一途徑
D.鹵代烴發生消去反應的條件是與強堿的乙醇溶液共熱
2.下列有機反應屬于取代反應的是下列有機反應屬于取代反應的是( )
A.
B.
C.
D.
3.在有機合成中官能團的引入或改變是極為重要的,下列說法正確的是( )
A.甲苯在光照下與反應,主反應為苯環上引入Cl原子
B.引入羥基的方法常有鹵代烴和酯的水解、烯烴的加成、醛類的還原
C.將與酸性溶液反應即可得到
D.1,3-丁二烯轉化為時,先與HCl發生1,2-加成,再水解得到
4.有機物X、Y、Z、W的轉化關系如圖所示。下列說法錯誤的是( )
A.滿足上述反應的X的結構有五種(不考慮立體異構)
B.Z能發生取代反應
C.W一定能使的溶液褪色
D.Y含有兩種官能團
5.下列離子方程式正確的是( )
A.用銀氨溶液檢驗乙醛中的醛基:
B.向苯酚鈉溶液中通入少量:
C.向氯乙烷中滴入溶液檢驗其中的氯元素:
D.將乙酸滴入新制的中:
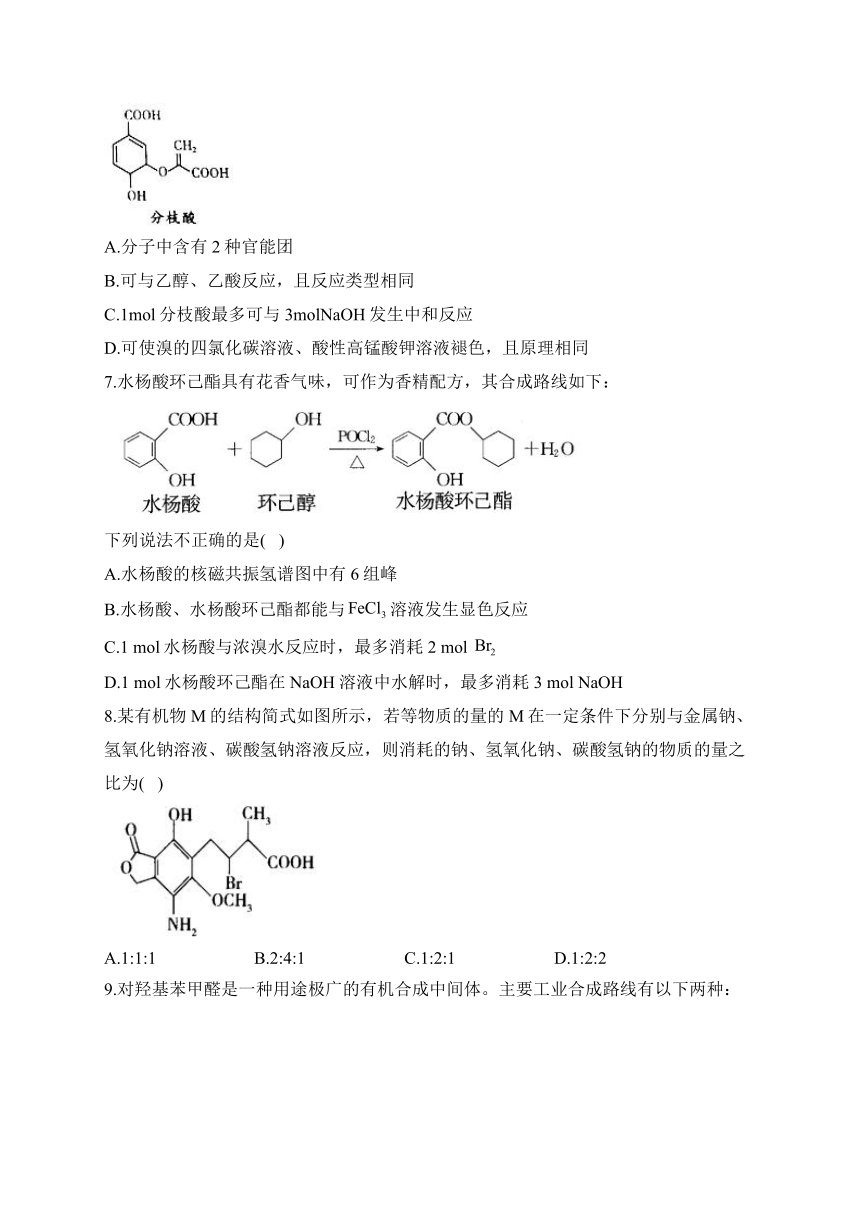
6.分枝酸可用于生化研究。其結構簡式如圖。下列關于分枝酸的敘述正確的是( )
A.分子中含有2種官能團
B.可與乙醇、乙酸反應,且反應類型相同
C.1mol分枝酸最多可與3molNaOH發生中和反應
D.可使溴的四氯化碳溶液、酸性高錳酸鉀溶液褪色,且原理相同
7.水楊酸環己酯具有花香氣味,可作為香精配方,其合成路線如下:
下列說法不正確的是( )
A.水楊酸的核磁共振氫譜圖中有6組峰
B.水楊酸、水楊酸環己酯都能與溶液發生顯色反應
C.1 mol水楊酸與濃溴水反應時,最多消耗2 mol
D.1 mol水楊酸環己酯在NaOH溶液中水解時,最多消耗3 mol NaOH
8.某有機物M的結構簡式如圖所示,若等物質的量的M在一定條件下分別與金屬鈉、氫氧化鈉溶液、碳酸氫鈉溶液反應,則消耗的鈉、氫氧化鈉、碳酸氫鈉的物質的量之比為( )
A.1:1:1 B.2:4:1 C.1:2:1 D.1:2:2
9.對羥基苯甲醛是一種用途極廣的有機合成中間體。主要工業合成路線有以下兩種:
下列說法正確的是( )
A.①的反應類型為取代反應
B.對羥基苯甲醇的一氯代物有4種(不考慮立體異構)
C.對羥基苯甲醛中所有原子不可能共面
D.對甲基苯酚的同分異構體中含有苯環的有4種(不包括其本身)
10.某有機物結構簡式如圖所示,下列關于該有機物的說法正確的是( )
A.1mol該有機物最多可消耗3molNaOH
B.該有機物的分子式為
C.1mol該有機物最多可與8mol發生加成反應
D.苯環上的一溴代物有6種
11.如圖所示是某有機合成中的部分片段。
下列說法錯誤的是( )
A.有機物甲可以發生加成反應、氧化反應、加聚反應
B.設計反應①的目的是保護醛基,防止其在反應②中被氧化
C.反應③的產物除丁以外,還有甲醇
D.利用酸性溶液可以鑒別物質乙和丙
12.松蘿酸常作為牙有和化妝品的添加劑,可由化合物X經過兩步反應制得。下列有關說法不正確的是( )
A.X、Y均能與溶液反應產生氣體
B.化合物X和Y與溶液均可發生顯色反應
C.1mol化合物X與飽和溴水反應時最多能消耗2 mol
D.1mol化合物Y最多能與8mol反應
第三部分:重難知識易混易錯
重難點1鹵代烴
一、鹵代烴
1.定義
烴分子中的氫原子被鹵素原子取代后生成的化合物稱為鹵代烴。官能團是碳鹵鍵,可表示為(X=F、Cl、Br、I)。
2.分類
3.物理性質
(1)狀態:常溫下,鹵代烴中除個別為氣體外,大多為液體或固體。如一氯甲烷為氣體。
(2)溶解性:鹵代烴不溶于水,可溶于有機溶劑,某些鹵代烴本身就是很好的有機溶劑,如CCl4、氯仿(CHCl3)等。
(3)密度與沸點:①鹵代烴的密度和沸點都高于相應的烴;
②鹵代烴的密度一般隨烴基中碳原子數目的增加而減小,如ρ(CH3Cl)>ρ(CH3CH2Cl);
③鹵代烴的沸點一般隨碳原子數目的增加而升高,如沸點CH3Cl<CH3CH2Cl。
4.鹵代烴的系統命名——類似于烴的命名方法
二、溴乙烷的結構與性質
1.溴乙烷的物理性質
純凈的溴乙烷是無色液體,沸點是38.4 ℃,密度比水的大,難溶于水,可溶于多種有機溶劑(如乙醇、苯、汽油等)。
2.溴乙烷的分子結構
3.溴乙烷的化學性質
(1)取代反應——又稱水解反應
①條件:NaOH水溶液、加熱。
②反應方程式:
C2H5—Br+NaOHC2H5—OH+NaBr。
③反應原理:
(2)消去反應——又稱為消除反應。
①條件:NaOH的乙醇溶液、加熱。
②反應方程式:(以溴乙烷為例)
CH3CH2Br+NaOHCH2===CH2↑+NaBr+H2O。
③反應原理:
④定義:有機化合物在一定條件下,從一個分子中脫去一個或幾個小分子(如H2O、HX等),而生成含不飽和鍵的化合物的反應叫做消去反應(消除反應)。
(3)加成和加聚反應
含有不飽和鍵(如)的鹵代烴也可以發生加成和加聚反應。
①氯乙烯加聚反應生成聚氯乙烯:
。
②四氟乙烯加聚反應生成聚四氟乙烯:。
重難點2醇 酚
一、醇的分類、組成與物理性質
1.醇與酚的定義
(1)醇是指羥基與飽和碳原子相連的化合物。如1 丙醇CH3CH2CH2OH,苯甲醇,可命名為3 甲基 2 戊醇。
(2)酚是指羥基與苯環直接相連而形成的化合物。如苯酚。
微點撥:醇的命名步驟:①選主鏈:含—OH的最長碳鏈,稱“某醇”;②編號碼:從離羥基最近的一端的碳原子依次編號;③寫名稱:醇的名稱前用阿拉伯數字標出羥基位置,用漢字數字標出羥基個數。如命名為1,2 丙二醇。
2.醇的分類與組成
按羥基數目分為一元醇、二元醇和多元醇,其中飽和一元醇的分子通式為CnH2n+1OH。乙二醇和丙三醇的分子式分別為C2H6O2、C3H8O3,結構簡式分別為、。
3.醇的物理性質
(1)甲醇、乙二醇與丙三醇(又叫甘油)及應用
甲醇(CH3OH)是無色、具有揮發性的液體,易溶于水,沸點為65 ℃。甲醇有毒,誤服會損傷視神經,甚至致人死亡。甲醇廣泛應用于化工生產,也可作為車用燃料。乙二醇和丙三醇都是無色、黏稠的液體,都易溶于水和乙醇,是重要的化工原料。
(2)溶解性:①醇在水中的溶解度隨著分子中碳原子數的增加而降低,原因是極性的—OH在分子中所占的比例逐漸減少。羥基越多,溶解度越大。
②醇的溶解度大于含有相同碳原子數烴類的溶解度,原因是醇分子中的羥基屬于極性基團且能與水形成氫鍵。
(3)熔沸點:①隨分子中碳原子數的增多,熔沸點逐漸升高。
②醇的沸點遠遠高于相對分子質量相近的烴、鹵代烴等的沸點,原因是醇分子之間形成了氫鍵(醇分子中羥基的氧原子與另一醇分子中羥基的氫原子間存在著氫鍵)。
微點撥:多元醇分子中存在多個羥基,彼此形成分子間氫鍵的概率增加,分子間作用力增強,故碳原子數相同的醇,隨著羥基數的增多,其沸點逐漸升高;此外,與水分子間形成氫鍵的概率也增大,從而使多元醇具有易溶于水的性質。
二、醇的化學性質(以乙醇為例)
醇的化學性質主要由羥基官能團決定。在醇分子中由于氧原子吸引電子能力比氫原子和碳原子強,使O—H和C—O的電子對都向氧原子偏移,使O—H和C—O易斷裂,即。
1.置換反應
與活潑金屬(如Na)發生置換反應,其反應方程式為
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,反應時乙醇分子斷裂的化學鍵為O—H。
2.取代反應
(1)酯化反應:與乙酸發生反應的方程式為
。
(2)與氫鹵酸反應
與HBr反應的化學方程式為
C2H5OH+HBrC2H5—Br+H2O,反應時,乙醇分子斷裂的鍵為C—O。
(3)分子間脫水生成醚
乙醇在濃硫酸作用下加熱至140 ℃時,生成乙醚,其反應方程式為CH3CH2OH+CH3CH2OHCH3CH2—O—CH2CH3+H2O。
注意:①乙醚是一種無色、易揮發的液體,沸點34.5 ℃,有特殊氣味,具有麻醉作用。乙醚微溶于水,易溶于有機溶劑,它本身是一種優良溶劑,能溶解多種有機物。
②醚的官能團叫醚鍵,表示為,醚的結構可用R—O—R′表示,R、R′都是烴基,可以相同也可以不同。
3.消去反應
乙醇在濃硫酸的作用下,加熱至170_℃時生成乙烯,反應方程式為CH3CH2OHCH2===CH2↑+H2O,濃硫酸的作用是催化劑和脫水劑。反應時乙醇分子斷的鍵是C—H與C—O。
4.氧化反應
(1)實例:
②乙醇被酸性重鉻酸鉀(K2Cr2O7)溶液氧化的過程為
(2)有機反應中的氧化、還原反應
①有機物分子中失去氫原子或加入氧原子的反應叫氧化反應。如乙醇在氧化劑的作用下失去氫原子轉化為乙醛,乙醛在氧化劑的作用下加入氧原子轉化為乙酸。
②有機物分子中加入氫原子或失去氧原子的反應叫還原反應。如烯烴與H2的加成反應,也屬于還原反應。
三、苯酚的組成、結構與物理性質
1.組成與結構
苯酚是一元酚,是酚類化合物最簡單的,分子式為C6H6O,結構可表示為或,官能團為羥基(—OH)。
2.物理性質
(1)純凈的苯酚是無色晶體,有特殊氣味,易被空氣氧化呈粉紅色。
(2)苯酚室溫下在水中的溶解度為9.2 g,當溫度高于65 ℃時能與水混溶,苯酚易溶于有機溶劑。
(3)苯酚有毒,對皮膚有腐蝕性,如不慎沾到皮膚上,應立即用乙醇沖洗,再用水沖洗。
四、苯酚的化學性質及應用
1.化學性質
(1)酸性——弱酸性,俗稱石炭酸
實驗步驟
實驗現象 得到渾濁液體 液體變澄清 液體變渾濁
反應方程式
結論 室溫下,苯酚在水中溶解度較小 苯酚能與NaOH溶液反應,表現出酸性 酸性:
微點撥:①苯酚與活潑金屬(如Na)也反應生成H2。
②苯酚鈉溶液通入CO2生成NaHCO3,酸性比HCO強。
(2)取代反應
實驗操作
實驗現象 試管中立即產生白色沉淀
化學方程式
應用 用于苯酚的定性檢驗和定量測定
解釋 羥基對苯環的影響,使苯環上羥基鄰、對位氫原子更活潑,易被取代
(3)顯色反應
苯酚與FeCl3溶液作用顯紫色,利用此性質也可以檢驗苯酚的存在。酚類物質一般都可以與FeCl3作用顯色,可用于檢驗其存在。
2.應用
(1)苯酚是一種重要的化工原料,廣泛用于制造酚醛樹脂、染料、醫藥、農藥等。
(2)苯酚的稀溶液可以直接殺菌消毒,如日常藥皂中常加入少量的苯酚。
3.危害:含酚類物質的廢水對生物具有毒害作用,會對水體造成嚴重污染。化工廠和煉焦廠的廢水中常含有酚類物質,在排放前必須經過處理。
重難點3醛 酮
一、乙醛的化學性質
1.還原反應(加成反應):
(1)催化加氫
乙醛蒸氣和H2能發生加成反應,生成乙醇。
反應方程式為CH3CHO+H2CH3CH2OH。
(2)與HCN加成
2.氧化反應:
(1)銀鏡反應:
①銀氨溶液制備:在潔凈的試管中加入1 mL 2%的AgNO3溶液,然后邊振蕩邊滴加2%的稀氨水,至最初產生的沉淀恰好溶解為止。
②反應現象:試管內壁出現光亮的銀鏡。
③有關方程式:
a.銀氨溶液配制:AgNO3+NH3·H2O===AgOH↓+NH4NO3;AgOH+2NH3·H2O===Ag(NH3)2OH+2H2O。
b.銀氨反應:CH3CHO+2Ag(NH3)2OHCH3COONH4+2Ag↓+3NH3+H2O
④應用:a.可用于檢驗醛基的存在;b.工業上用于制鏡或保溫瓶膽。
(2)與新制Cu(OH)2的反應:
實驗操作
實驗現象 ①中溶液出現藍色絮狀沉淀,滴入乙醛,加熱至沸騰后,③中溶液有紅色沉淀產生
有關方程式 ①中:2NaOH+CuSO4==Cu(OH)2↓+Na2SO4 ③中:CH3CHO+2Cu(OH)2+NaOH CH3COONa+Cu2O↓+3H2O
(3)催化氧化:乙醛在有催化劑并加熱的條件下,能被氧氣氧化為乙酸,反應的化學方程式為2CH3CHO+O22CH3COOH。
氧化規律:—CHO —COOH
(4)燃燒反應方程式:2CH3CHO+5O24CO2+4H2O。
二、醛類
1.醛
(1)概念:分子里由烴基與醛基相連接而形成的化合物。
注意:①醛基要寫成—CHO,而不能寫成—COH。
②醛一定含有醛基,但含有醛基的物質不一定是醛(如甲酸、甲酸鹽、甲酸酯、葡萄糖、麥芽糖等都含有醛基),但它們都具有醛基的化學性質。
(2)官能團:醛基(—CHO)。
(3)通式:飽和一元醛為CnH2nO或CnH2n+1CHO。
2.甲醛、乙醛的比較
甲醛(蟻醛) 乙醛
分子式 CH2О C2H4О
結構簡式 HCHO CH3CHO
物理性質 顏色 無色 無色
氣味 有刺激性氣味 有刺激性氣味
狀態 氣態 氣態
溶解性 易溶于水,35%~40%的甲醛水溶液又稱福爾馬林 能與水、乙醇等互溶
三、酮
1.酮的結構
酮是由羰基()與兩個烴基相連的化合物。可表示為。
2.丙酮
(1)結構
丙酮是最簡單的酮類,結構簡式為。
(2)物理性質
常溫下,丙酮是無色透明的液體,易揮發,具有令人愉快的氣味,能與水、乙醇等混溶。
(3)化學性質
丙酮不能被銀氨溶液、新制Cu(OH)2懸濁液等弱氧化劑氧化,但能催化加氫生成2 丙醇。
重難點4羧酸
1.羧酸的定義與通式
(1)定義:由烴基(或氫原子)與羧基相連而構成的有機化合物,其官能團的名稱為羧基,簡式為—COOH。
(2)通式:飽和一元脂肪酸的通式為CnH2nO2或CnH2n+1COOH。
2.羧酸的分類
(1)按與羧基相連的烴基不同,羧酸分為脂肪酸和芳香酸(如苯甲酸)。
(2)按羧基數目,羧酸分為一元羧酸、二元羧酸和多元羧酸等。如二元羧酸(乙二酸:)。
3.常見羧酸
(1)甲酸——最簡單的羧酸,俗稱蟻酸。
①甲酸分子的結構為,含有的官能團為醛基(—CHO)和羧基(—COOH),具有醛和羧酸的性質。
②甲酸是一種無色、有刺激性氣味的液體,有腐蝕性,能與水、乙醇等互溶。
(2)苯甲酸——俗稱安息香酸
苯甲酸是一種無色晶體,易升華,微溶于水,易溶于乙醇。其鈉鹽是常用的食品防腐劑。
(3)乙二酸——俗稱草酸。
乙二酸是二元羧酸,無色晶體,可溶于水和乙醇。常用于化學分析的還原劑。
(4)羥基酸——具有羥基和羧基性質。
乳酸與檸檬酸是羥基酸,其結構簡式分別為
4.飽和一元羧酸的物理性質變化規律
(1)隨分子中碳原子數的增加,溶解度迅速減小,沸點逐漸升高。
(2)羧酸與相對分子質量相當的其他有機物相比,沸點較高,這與羧酸分子間可以形成氫鍵有關。
5.羧酸的化學性質
羧酸反應時,羧基()中①②號極性鍵斷裂。
(1)酸性——弱酸,具有酸類的性質
寫出下列化學方程式
①HCOOH與NaHCO3反應:HCOOH+NaHCO3===HCOONa+CO2↑+H2O。
②苯甲酸與NaOH反應:
。
③乙二酸與NaOH反應:。
(2)酯化反應(乙酸與乙醇反應)
①乙酸與乙醇的酯化反應方程式:
。
②原理:
用同位素示蹤法探究酯化反應中的脫水方式。用含有示蹤原子的CH3CHOH與CH3COOH反應,化學方程式為
,
說明酯化反應時,羧基脫—OH,醇羥基脫H。
微點撥:酯化反應是可逆反應,濃硫酸在此反應中作催化劑和吸水劑。
重難點5羧酸衍生物
一、酯
1.組成、結構和命名
2.酯的性質
(1)物理性質
低級酯是具有芳香氣味的液體,密度一般小于水,難溶于水,易溶于乙醇、乙醚等有機溶劑。
(2)化學性質——水解反應(以乙酸乙酯為例)
①酸性條件下水解
CH3COOC2H5+H2OCH3COOH+C2H5OH。
②堿性條件下水解
CH3COOC2H5+NaOHCH3COONa+C2H5OH。
微點撥:①酯的酸性水解與酯化反應均為可逆反應和取代反應。
②酯的堿性水解,由于生成了羧酸鹽,水解反應不可逆,也屬于取代反應。
二、油脂
1.油脂的形成、結構與分類
(1)形成:日常生活中食用的油脂是由高級脂肪酸與甘油形成的酯,屬于酯類化合物。
硬脂酸(C17H35COOH)、油酸(C17H33COOH)與甘油(丙三醇)反應生成油脂的化學方程式分別為3C17H35COOH+
(2)結構
油脂的結構可表示為
其中R、R′、R″是高級脂肪酸的烴基,可以相同也可以不同。
(3)分類
(4)常見高級脂肪酸
名稱 飽和脂肪酸 不飽和脂肪酸
軟脂酸 硬脂酸 油酸 亞油酸
示性式 C15H31COOH C17H35COOH C17H33COOH C17H31COOH
2.油脂的化學性質
油脂是多種高級脂肪酸的甘油酯,而在高級脂肪酸中,既有飽和的,又有不飽和的,因而油脂不僅具有酯的化學性質,還兼有烯烴的化學性質。
(1)油脂的水解(以硬脂酸甘油酯為例)
①酸性條件下水解方程式:
②堿性(以氫氧化鈉溶液為例)條件下水解方程式:
油脂在堿性溶液中的水解反應又稱為皂化反應。工業上常用于生產肥皂。
(2)油脂的氫化——油脂的加成反應
①油脂氫化的定義
不飽和程度較高、熔點較低的液態油,通過催化加氫可提高飽和度,轉變成半固態的脂肪,這個過程稱為油脂的氫化,也稱油脂的硬化。
②應用:制造人造脂肪(硬化油),防止了油脂的氧化變質,便于儲存和運輸。
③油酸甘油酯氫化反應方程式為
。
微點撥:①乙酸乙酯在堿性條件下也能發生水解反應,但不是皂化反應。
②肥皂的主要成分為高級脂肪酸的鹽。
③熱的純堿溶液可以提高去除油脂的效果。因為熱的純堿水解程度大,堿性強使油脂易水解。
三、酰胺
1.胺
(1)定義:烴基取代氨分子中的氫原子而形成的化合物。
(2)通式可表示為R—NH2,官能團的名稱為氨基。如甲胺的結構簡式為CH3—NH2,苯胺的結構簡式為。
(3)主要性質:胺類化合物具有堿性。
苯胺與鹽酸反應的化學方程式為。
(4)用途:胺的用途很廣,是重要的化工原料。例如,甲胺和苯胺都是合成醫藥、農藥和染料等的重要原料。
2.酰胺
(1)定義:羧酸分子中羥基被氨基所替代得到的化合物。
(2)通式表示為,其中叫做酰基,叫做酰胺基。
(3)常見酰胺的結構簡式:
乙酰胺,苯甲酰胺,N,N 二甲基甲酰胺
(4)酰胺()的水解反應方程式
①酸性(HCl溶液):RCONH2+H2O+HClRCOOH+NH4Cl,
②堿性(NaOH溶液):RCONH2+NaOHRCOONa+NH3↑。
(5)應用
酰胺常被用作溶劑和化工原料。例如,N,N 二甲基甲酰胺是良好的溶劑,可以溶解很多有機化合物和無機化合物,是生產多種化學纖維的溶劑,也用于合成農藥、醫藥等。
重難點6有機合成
一、有機合成的主要任務
1.構建碳骨架:包括碳鏈的增長、縮短與成環等
(1)碳鏈的增長
③羥醛縮合反應:含有α H的醛在一定條件下可發生加成反應,生成β 羥基醛,進而發生消去反應。
(2)碳鏈的縮短
(3)碳鏈成環
共軛二烯烴(含有兩個碳碳雙鍵,且兩個雙鍵被一個單鍵隔開的烯烴,如1,3 丁二烯)與含碳碳雙鍵的化合物在一定條件下發生第爾斯 阿爾德反應(Diels Alder reaction),得到環加成產物,構建了環狀碳骨架。
2.引入官能團
引入官能團的反應類型常見的有取代、加成、消去、氧化還原等。
(1)引入—OH生成醇的反應有
烯與H2O加成,鹵代烴水解,酯水解,酮、醛與H2加成等。
(2)引入的反應有醇與鹵代烴的消去反應等。
3.官能團的保護
含有多個官能團的有機物在進行反應時,非目標官能團也可能受到影響。此時需要將該官能團保護起來,先將其轉化為不受該反應影響的其他官能團,反應后再轉化復原。如—OH保護過程:
二、有機合成路線的設計與實施
1.合成的設計方法
(1)從原料出發設計合成路線的方法步驟
基礎原料通過有機反應形成一段碳鏈或連上一個官能團,合成第一個中間體;在此基礎上,利用中間體的官能團,加上輔助原料,進行第二步反應,合成出第二個中間體……經過多步反應,最后得到具有特定結構和功能的目標化合物。
示例:乙烯合成乙酸的合成路線為
(2)從目標化合物出發逆合成分析法的基本思路
基本思路是在目標化合物的適當位置斷開相應的化學鍵,目的是使得到的較小片段所對應的中間體經過反應可以得到目標化合物;接下來繼續斷開中間體適當位置的化學鍵,使其可以從更上一步的中間體反應得來;依次倒推,最后確定最適宜的基礎原料和合成路線。可以用符號“”表示逆推過程,用箭頭“→”表示每一步轉化反應。
示例:乙烯合成乙二酸二乙酯的合成路線逆向合成圖(用“”表示逆推過程)
可以得出正向合成路線圖:
。
2.設計合成路線的基本原則
(1)步驟較少,副反應少,反應產率高;
(2)原料、溶劑和催化劑盡可能價廉易得、低毒;
(3)反應條件溫和,操作簡便,產物易于分離提純;
(4)污染排放少;
(5)在進行有機合成時,要貫徹“綠色化學”理念等。
3.有機合成的發展史
(1)20世紀初,維爾施泰特通過十余步反應合成顛茄酮,總產率僅有0.75%。十幾年后,羅賓遜僅用3步反應便完成合成,總產率達90%。
(2)20世紀中后期,伍德沃德與多位化學家合作,成功合成了奎寧、膽固醇、葉綠素、紅霉素、維生素B12等一系列結構復雜的天然產物。
(3)科里提出了系統化的逆合成概念,開始利用計算機來輔助設計合成路線。
總之,有機合成的發展,使人們不僅能通過人工手段合成原本只能從生物體內分離、提取的天然產物,還可以根據實際需要設計合成具有特定結構和性能的新物質。
第四部分:核心素養對接高考
1.[2023年浙江高考真題]下列說法不正確的是( )
A.通過X射線衍射可測定青蒿素晶體的結構
B.利用鹽析的方法可將蛋白質從溶液中分離
C.苯酚與甲醛通過加聚反應得到酚醛樹脂
D.可用新制氫氧化銅懸濁液鑒別苯、乙醛和醋酸溶液
2.[2022年浙江高考真題]下列說法不正確的是( )
A.植物油含有不飽和高級脂肪酸甘油酯,能使溴的四氯化碳溶液褪色
B.向某溶液中加入茚三酮溶液,加熱煮沸出現藍紫色,可判斷該溶液含有蛋白質
C.麥芽糖、葡萄糖都能發生銀鏡反應
D.將天然的甘氨酸、丙氨酸、苯丙氨酸混合,在一定條件下生成的鏈狀二肽有9種
3.[2023年福建高考真題]抗癌藥物CADD522的結構如下圖。關于該藥物的說法錯誤的是( )
A.該抗癌藥物能發生水解反應 B.含有2個手性碳原子
C.能使的溶液褪色 D.碳原子雜化方式有和
4.[2023年遼寧高考真題]在光照下,螺呲喃發生開、閉環轉換而變色,過程如下。下列關于開、閉環說法正確是( )
A.均有手性碳原子 B.互為同分異構體
C.N原子雜化方式相同 D.閉環螺吡喃親水性更好
5.[2022年重慶高考真題]下列關于M的說法正確的是( )
A.分子式為
B.含有3個手性碳原子
C.所有氧原子共平面
D.與互為同系物
6.[2023年河北高考真題]在K-10蒙脫土催化下,微波輻射可促進化合物X的重排反應,如下圖所示:
下列說法錯誤的是( )
A.Y的熔點比Z的高 B.X可以發生水解反應
C.Y、Z均可與發生取代反應 D.X、Y、Z互為同分異構體
7.[2022年北京高考真題]我國科學家提出的聚集誘導發光機制已成為研究熱點之一。一種具有聚集誘導發光性能的物質,其分子結構如圖所示。下列說法不正確的是( )
A.分子中N原子有兩種雜化方式
B.分子中含有手性碳原子
C.該物質既有酸性又有堿性
D.該物質可發生取代反應、加成反應
8.[2023年重慶高考真題]橙皮苷廣泛存在于臍橙中,其結構簡式(未考慮立體異構)如下所示:
關于橙皮苷的說法正確的是( )
A.光照下與氯氣反應,苯環上可形成鍵
B.與足量水溶液反應,鍵均可斷裂
C.催化劑存在下與足量氫氣反應,π鍵均可斷裂
D.與醇溶液反應,多羥基六元環上可形成π鍵
9.[2023年江蘇高考真題]化合物Z是合成藥物非奈利酮的重要中間體,其合成路線如下:
下列說法正確的是( )
A.X不能與溶液發生顯色反應
B.Y中的含氧官能團分別是酯基、羧基
C.1molZ最多能與發生加成反應
D.X、Y、Z可用飽和溶液和2%銀氨溶液進行鑒別
10.[2023年海南高考真題]閉花耳草是海南傳統藥材,具有消炎功效。車葉草苷酸是其活性成分之一,結構簡式如圖所示。下列有關車葉草苷酸說法正確的是( )
A.分子中含有平面環狀結構
B.分子中含有5個手性碳原子
C.其鈉鹽在水中的溶解度小于在甲苯中的溶解度
D.其在弱堿介質中可與某些過渡金屬離子形成配合物
參考答案
第二部分:教材習題變式
1.答案:D
解析:若與鹵素原子直接相連C原子的鄰位C原子上沒有H原子,則該氯代烴不能發生消去反應,如一氯甲烷等,A錯誤;苯酚與濃溴水反應生成的2,4,6-三溴苯酚溶于苯,過濾無法除去,B錯誤;消去反應是引入碳碳雙鍵的途徑,但不是唯一途徑,還可以通過碳碳三鍵與發生加成反應等途徑生成碳碳雙鍵,C錯誤。
2.答案:C
解析:被氧化,屬于氧化反應,A不符合題意;被氧化,屬于氧化反應,B不符合題意;中羥基被溴原子取代,生成,C符合題意;乙炔中的碳碳三鍵變成碳碳雙鍵,屬于加成反應,D不符合題意。
3.答案:B
解析:甲苯與在光照條件下反應時,甲基上的氫原子被Cl原子取代,A錯誤;鹵代烴和酯發生水解反應均可得到醇,引入羥基,烯烴與水加成、醛類與加成都可引入羥基,B正確;酸性溶液既可氧化碳碳雙鍵,又可氧化,不能得到,C錯誤;1,3-丁二烯轉化為的流程為先與溴水發生1,4-加成得到,再水解得到,最后與HCl加成可得,D錯誤。
4.答案:C
解析:由轉化關系可知,X可與碳酸氫鈉反應,則其含有羧基;可在濃硫酸作用下加熱與乙酸發生反應生成Y,則其含有羥基,X應為羥基丁酸。可看作—OH取代了丁酸中的一個H原子,丁酸有兩種結構,對應的羥基丁酸有5種,A正確;Z為羥基丁酸鈉,能發生取代反應,B正確;W可為丁烯酸或環酯,若為環酯,則與溴的四氯化碳溶液不反應,C錯誤;Y中含有酯基和羧基兩種官能團,D正確。
5.答案:D
解析:為易溶于水的強電解質,應拆寫成離子形式,A錯誤;苯酚的酸性強于,苯酚鈉溶液與反應生成苯酚和,反應的離子方程式為,B錯誤;氯乙烷不溶于水,不能電離出,則向氯乙烷中滴入溶液,不發生反應,C錯誤。
6.答案:B
解析:A項,該化合物分子中含有羧基、醇羥基、醚鍵和碳碳雙鍵4種官能團,故A項錯誤;
B項,該物質中含有羧基和羥基,既可以與乙醇發生酯化反應,也可以與乙酸發生酯化反應,反應類型相同,故B項正確;
C項,分枝酸一個分子中含兩個羧基,故1mol分枝酸最多能與2molNaOH發生中和反應,故C項錯誤;
D項,該物質使溴的四氯化碳溶液褪色的原理是溴與碳碳雙鍵發生加成反應,而是使酸性高錳酸鉀溶液褪色是發生氧化反應,原理不同,故D項錯誤。
故選B。
7.答案:D
解析:水楊酸中含有6種不同化學環境的氫原子,故其在核磁共振氫譜圖中有6組峰,A正確;水楊酸、水楊酸環己酯中均含有酚羥基,故均可與溶液發生顯色反應,B正確;水楊酸與濃溴水發生取代反應時,其酚羥基鄰、對位上的H原子能被取代,所以1 mol水楊酸與足量濃溴水反應時,最多消耗2 mol ,C正確;水楊酸環己酯中含有1個酯基和1個酚羥基,1 mol水楊酸環己酯在NaOH溶液中水解,最多消耗2 mol NaOH,D錯誤。
8.答案:B
解析:金屬鈉可以與M中的酚羥基、羧基發生反應;氫氧化鈉溶液能使酯基和溴原子發生水解,也能與酚羥基和羧基反應;碳酸氫鈉溶液只能與羧基發生反應,因此1molM消耗的鈉、氫氧化鈉、碳酸氫鈉的物質的量分別為2mol、4mol、1mol。
9.答案:D
解析:甲醛中鍵中的一個鍵斷裂,酚羥基對位C—H鍵斷裂,C原子和H原子分別連在甲醛中斷裂的碳氧雙鍵兩端,則①的反應類型為加成反應,A錯誤;對羥基苯甲醇中有5種不同化學環境的氫原子,其一氯代物有5種,B錯誤;苯環、醛基都是平面形結構,單鍵可以旋轉,則對羥基苯甲醛中所有原子可能共面,C錯誤;對甲基苯酚含有苯環的同分異構體有:鄰甲基苯酚、間甲基苯酚、苯甲醇、苯甲醚,共有4種,D正確。
10.答案:D
解析:該物質中含有酯基、羧基、酚羥基,酯基水解生成羧基、酚羥基,所以1mol該有機物最多可消耗4molNaOH,A錯誤;根據結構簡式確定該有機物分子式為,B錯誤;該物質中只有兩個苯環能和氫氣發生加成反應,所以1mol該有機物最多可與6mol發生加成反應,C錯誤;左邊苯環上有兩種氫原子、右邊苯環上有4種氫原子,所以兩個苯環上共有6種氫原子,則該物質苯環上的一溴代物有6種,D正確。
11.答案:D
解析:有機物甲中含有碳碳雙鍵,可以發生加成反應、加聚反應、氧化反應,A正確;醛基具有較強的還原性,極易被氧化,根據流程可知,設計反應①的目的是保護醛基,防止其在反應②中被氧化,B正確;對比丙、丁的結構可知,反應③的產物除丁以外,還有甲醇,C正確;乙分子中含有碳碳雙鍵,能使酸性溶液褪色,丙分子中含有羥基,也能使酸性溶液褪色,D錯誤。
12.答案:A
解析:X、Y都不含羧基,都不能與溶液反應產生氣體,A錯誤;化合物X和Y都含有酚羥基,所以都能與溶液發生顯色反應,B正確;如圖所示,,畫圈位置能與溴發生取代反應,故1mol化合物X與飽和溴水反應時最多消耗2mol,C正確;化合物Y中的苯環、羰基、碳碳雙鍵能與氫氣發生加成反應,故1mol化合物Y最多能與8mol反應,D正確。
第四部分:核心素養對接高考
1.答案:C
解析:解:A.通過X射線晶體衍射,可以測定青蒿素分子的空間結構,故A正確;
B.蛋白質在鹽溶液中可發生鹽析生成沉淀,過濾可分離,故B正確;
C.苯酚與甲醛通過縮聚反應得到酚醛樹脂,故C錯誤;
D.乙醛和新制氫氧化銅懸濁液加熱生成磚紅色沉淀,醋酸能和新制氫氧化銅懸濁液發生中和反應,苯和新制氫氧化銅懸濁液不反應出現分層,故可以用新制氫氧化銅懸濁液鑒別苯、乙醛和醋酸溶液,故D正確;
故選:C。
2.答案:B
解析:植物油含不飽和高級脂肪酸甘油酯,含有碳碳雙鍵,能使溴的四氯化碳溶液褪色,A項正確;茚三酮是檢驗氨基酸的試劑,向某溶液中加入茚三酮溶液,加熱煮沸出現藍紫色,可判斷該溶液中含有氨基酸,B項錯誤;麥芽糖、葡萄糖都含有醛基,都能發生銀鏡反應,C項正確;將天然的甘氨酸、丙氨酸、苯丙氨酸混合,在一定條件下自身兩兩縮合生成的鏈狀二肽有三種,甘氨酸和丙氨酸、苯丙氨酸形成兩種鏈狀二肽,苯丙氨酸和丙氨酸、甘氨酸形成兩種鏈狀二肽,丙氨酸和甘氨酸、苯丙氨酸形成兩種鏈狀二肽,共9種,D項正確。
3.答案:B
解析:A.分子中有肽鍵,因此在酸或堿存在并加熱條件下可以水解,A正確;
B.標注*這4個碳原子各連有4個各不相同的原子或原子團,因此為手性碳原子,B錯誤;
C.分子中含有碳碳雙鍵,因此能使能使的溶液褪色,C正確;
D.分子中雙鍵碳原子為雜化,飽和碳原子為雜化,D正確;
故選B。
4.答案:B
解析:開環螺吡喃中不含手性碳原子,不具有手性,A項錯誤;
二者分子式均為,結構不同,因此互為同分異構體,B項正確;
閉環螺吡喃中的N原子形成3個σ鍵,有一個孤電子對,為雜化,開環螺吡喃中的N原子形成3個σ鍵,無孤電子對,為雜化,C項錯誤;
開環螺吡喃為帶有正、負電荷的離子,其親水性更好,D項錯誤。
5.答案:B
解析:由M的結構簡式可知,其分子式為,A錯誤;同時連有4個互不相同的原子或原子團的碳原子為手性碳原子,故M中含有3個手性碳原子,如圖所示:(標*的碳原子為手性碳),B正確;M分子中存在飽和碳原子,與飽和碳原子相連的4個原子或原子團為四面體結構,則M中所有氧原子不可能共平面,C錯誤;同系物是指結構相似(官能團的種類和數目分別相同),組成上相差一個或若干個(“”),原子團的有機化合物,M與結構不同,組成上也不相差若干“”,不互為同系物,D錯誤。
6.答案:A
解析:A.分子間氫鍵使物質的熔點升高,分子內氫鍵使物質的熔點降低;Z易形成分子間氫鍵、Y易形成分子內氫鍵,Y的熔點比Z的低,故A錯誤;
B.X含有酯基,可以發生水解反應,故B正確;
C.Y、Z均含有酚羥基,所以均可與發生取代反應,故C正確;
D.X、Y、Z分子式都是,結構不同,互為同分異構體,故D正確;
故選:A。
7.答案:B
解析:A.該分子中形成鍵的N雜化方式為,形成N—C鍵的N雜化方式為,項正確;
B.手性碳原子是連有4個不同原子或原子團的飽和碳原子,該分子中無手性碳原子,項錯誤;
C.該物質含有,能與酸反應,含有羧基,能與堿反應,項正確;
D.該物質含有苯環,能發生加成反應,含有羧基,能發生酯化反應(屬于取代反應),D項正確。
故選B。
8.答案:C
解析:解:A.催化劑條件下,苯環上H原子可被取代,則催化劑條件下與氯氣反應,苯環上可形成C—Cl鍵,不能在光照條件下,故A錯誤;
B.只有酚羥基與NaOH溶液反應,則只有2個酚羥基上的O—H鍵斷裂,故B錯誤;
C.苯環、羰基均與氫氣發生加成反應,則催化劑存在下與足量氫氣反應,π鍵均可斷裂,故C正確;
D.醇在濃硫酸、加熱條件下發生消去反應,多羥基六元環上可形成π鍵,不能選NaOH醇溶液,故D錯誤;
故選:C。
9.答案:D
解析:A.X中含有酚羥基,能與溶液發生顯色反應,A錯誤;
B.Y中的含氧官能團分別是酯基、醚鍵,B錯誤;
C.Z中1 mol苯環可以和發生加成反應,1 mol醛基可以和發生加成反應,故1 mol Z最多能與發生加成反應,C錯誤;
D.X可與飽和溶液反應產生氣泡,Z可以與2%銀氨溶液反應產生銀鏡,Y無明顯現象,故X、Y、Z可用飽和溶液和2%銀氨溶液進行鑒別,D正確。
故選D。
10.答案:D
解析:A.環狀結構中含有多個雜化原子相連,故分子中不一定含有平面環狀結構,故A錯誤;
B.分子中含有手性碳原子如圖標注所示:,共9個,故B錯誤;
C.其鈉鹽是離子化合物,在水中的溶解度大于在甲苯中的溶解度,故C錯誤;
D.羥基中氧原子含有孤對電子,在弱堿介質中可與某些過渡金屬離子形成配合物,故D正確;
答案為:D。
展開更多......
收起↑
 資源預覽
資源預覽