資源簡介
資源簡介
第6講 常見的酸堿鹽
命題點1 溶液的酸堿性和pH
1. (易錯易混)下列說法正確的是( )
A. 溶液pH越大,酸性越強
B. 用pH試紙測得某酸性溶液的pH為6.2
C. 用濕潤的pH試紙測定白醋的pH,結果會偏大
D. 酸雨的pH小于7,則pH小于7的雨水一定是酸雨
2. (易錯易混) 下列推理正確的是( )
A. 酸能使紫色石蕊溶液變紅,則能使紫色石蕊溶液變紅的一定是酸溶液
B. 顯堿性的溶液能使無色酚酞溶液變紅,則能使無色酚酞溶液變紅的溶液一定是堿溶液
C. 用紫色石蕊溶液可以鑒別稀鹽酸和氯化鈉溶液,則用無色酚酞溶液也可以
D. 用無色酚酞溶液可以鑒別氫氧化鈉溶液和二氧化碳的水溶液,則用紫色石蕊溶液也可以
[知識逐點過]
1. 指示劑在不同酸堿性溶液中的顏色
指示劑 酸性溶液 堿性溶液 中性溶液
紫色石蕊溶液 ____色 ____色 紫色
無色酚酞溶液 ____色 ____色 無色
2. 溶液的酸堿性和pH
溶液酸堿性與pH 常用①__________測定溶液的pH,即溶液的②____________,pH范圍通常為0~14。溶液pH與溶液酸堿性的關系為
酸堿度的應用 a. 測定土壤的酸堿性,提供土壤改良的依據;b. 測定雨水的pH,pH<⑥______的降雨稱為酸雨;c. 醫院通過測定人體的血液、尿液的pH來判斷是否健康
[拓展訓練]
1. 下列常見物質的pH大于7的是( )
A. 食醋 B. 食鹽水 C. 氨水 D. 檸檬水
2. 下列水果中酸度最強的是( )
3. 為了鑒別稀鹽酸和NaOH溶液,小英要測定溶液的pH,正確的操作是________________________________________________。測得pH=1的溶液為____________。
4. 酸堿指示劑的發現是英國科學家波義耳在一次實驗中不小心將濃鹽酸濺到一束紫羅蘭上,為了洗掉花瓣上的酸,他馬上對花瓣進行沖洗,一會兒卻驚奇地發現紫羅蘭變成了紅色。他沒有放過這一偶然的發現,而是進行了進一步的實驗和思考。下列試劑中能使紫羅蘭花瓣變紅的是( )
A. NaCl溶液 B. NaOH溶液 C. 稀硫酸 D. Na2CO3溶液
5. 健康人的體液必須維持在一定的酸堿度范圍內,如果出現異常,則可能導致疾病。下表是人體內的一些體液和排泄物的正常pH范圍,下列有關說法正確的是( )
血漿 胃液 膽汁 尿液
pH 7.35~7.45 0.9~1.5 7.1~7.3 4.7~8.4
A. 當膽汁pH<7.1或pH>7.3時,人體可能導致疾病
B. 胃液一定顯酸性,尿液一定顯堿性
C. 可使用廣范 pH試紙測定血漿的 pH是否在正常范圍內
D. 膽汁、血漿都呈堿性且膽汁的堿性比血漿強
命題點2 常見酸的性質及用途
1. (易錯易混)下列有關酸的敘述中正確的是( )
A. 酸中都含有氫元素,則含有氫元素的化合物一定是酸
B. 濃鹽酸具有揮發性,所以濃硫酸也具有揮發性
C. 打開濃鹽酸的瓶蓋時,瓶口處看到白霧
D. 濃硫酸使紙張炭化是利用了其吸水性
2. 在學習完酸的相關性質后,化學興趣小組的同學構建了如圖所示的“酸的化學性質”知識樹,圖中是稀鹽酸與甲、乙、丙、丁、戊五種常見物質反應出現的不同現象。
(1)若甲是紫色石蕊溶液,則“?”處的現象為____________________________________________。
(2)若乙與戊均為氧化物,則乙為____________,稀鹽酸與戊反應的化學方程式為________________________________________________________________________。
(3)稀鹽酸與丙反應的基本反應類型為________________。
(4)若生成的無色氣體為氫氣,寫一種符合要求的丁__________;若丁為碳酸鹽,寫出檢驗所生成氣體的方法______________________________。
[知識逐點過]
1. 酸的概念:在水溶液中解離出的陽離子全部是________的化合物。
2. 常見的酸及其用途
鹽酸(HCl) 硫酸(H2SO4)
色、味、態 純凈的濃鹽酸是無色、有刺激性氣味的液體 純凈的濃硫酸是無色、無味、黏稠的油狀液體
打開盛濃酸試劑瓶 瓶口形成白霧,原因是濃鹽酸易________ 無明顯現象
用途 人體胃液中含有鹽酸,可以幫助消化; 金屬除銹等 a.用于金屬除銹; b.其濃溶液在實驗室可用作________
3. 其他常見的酸:碳酸(H2CO3)、醋酸(CH3COOH)、硝酸(HNO3)。
4. 濃硫酸的特性和稀釋
吸水性 濃硫酸具有吸水性,在實驗室可用作____________,可用來干燥中性或酸性氣體(如O2、H2、CO2等)(物理性質)
腐蝕性 能奪取紙張、木材里的水分,生成黑色的炭(化學性質)
濃硫酸的稀釋:將濃硫酸沿器壁慢慢注入水中,并用玻璃棒不斷攪拌
5. 酸的化學性質
化學性質 化學方程式及反應現象
與酸堿指示劑作用 能使紫色石蕊溶液變①______色,不能使無色酚酞溶液變色
與活潑金屬反應 通式:酸+活潑金屬―→鹽+H2↑ 稀鹽酸與鐵:②______________________; 現象:③_______________________________________
與金屬氧化物反應 通式:酸+金屬氧化物―→鹽+水 稀鹽酸與氧化鐵:④____________________; 現象:⑤________________
與堿反應 通式:酸+堿―→鹽+水 稀鹽酸與氫氧化鈉:⑥____________________________
與鹽反應 通式:酸+鹽―→新酸+新鹽 稀硫酸與碳酸鈉:⑦__________________; 現象:⑧__________________ 稀鹽酸與碳酸鈣:⑨______________________________
總結: 稀硫酸和稀鹽酸化學性質相似的原因是⑩_________________________________
【備考補充】稀鹽酸和稀硫酸的特性
稀鹽酸與硝酸銀反應 稀硫酸與氯化鋇溶液反應
化學方程式 _____________________ ______________________________
現象 ____________________________ ______________________________
總結:酸的化學性質不完全相同的原因是______________________________________
[構建物質網絡]
1. 請寫出下列物質的化學式
甲________________
燒堿__________________
2. 請寫出圖中對應標號的化學方程式(共性部分以HCl為例)
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________;
④________________________________________________________________________;
⑤________________________________________________________________________;
⑥________________________________________________________________________。
[拓展訓練]
1. 下列試劑瓶應用標志的是( )
A. 氯化鈉 B. 蒸餾水 C. 濃硫酸 D. 葡萄糖
2. 用硫酸進行下列實驗,存在錯誤的做法是( )
A. 干燥:用濃硫酸作為某些氣體的干燥劑
B. 稀釋:將 10 g溶質質量分數為 98%的濃硫酸稀釋成 10%的稀硫酸需加入 90 g的水
C. 制備:用稀硫酸與鋅粒反應來制取氫氣
D. 除銹:用適量的稀硫酸除去鐵釘表面的鐵銹
3. 硫酸和鹽酸是工農業生產中重要的兩種酸。下列有關說法正確的是( )
①它們都能使紫色石蕊溶液變紅;②打開盛有濃鹽酸的試劑瓶,瓶口有白霧出現,說明分子在不斷運動;③將兩瓶濃溶液敞放在空氣中,溶液質量都減小;④稀硫酸和氯化鋇溶液發生復分解反應生成鹽酸
A. ①②③④ B. ①②④ C. ①②③ D. ①③
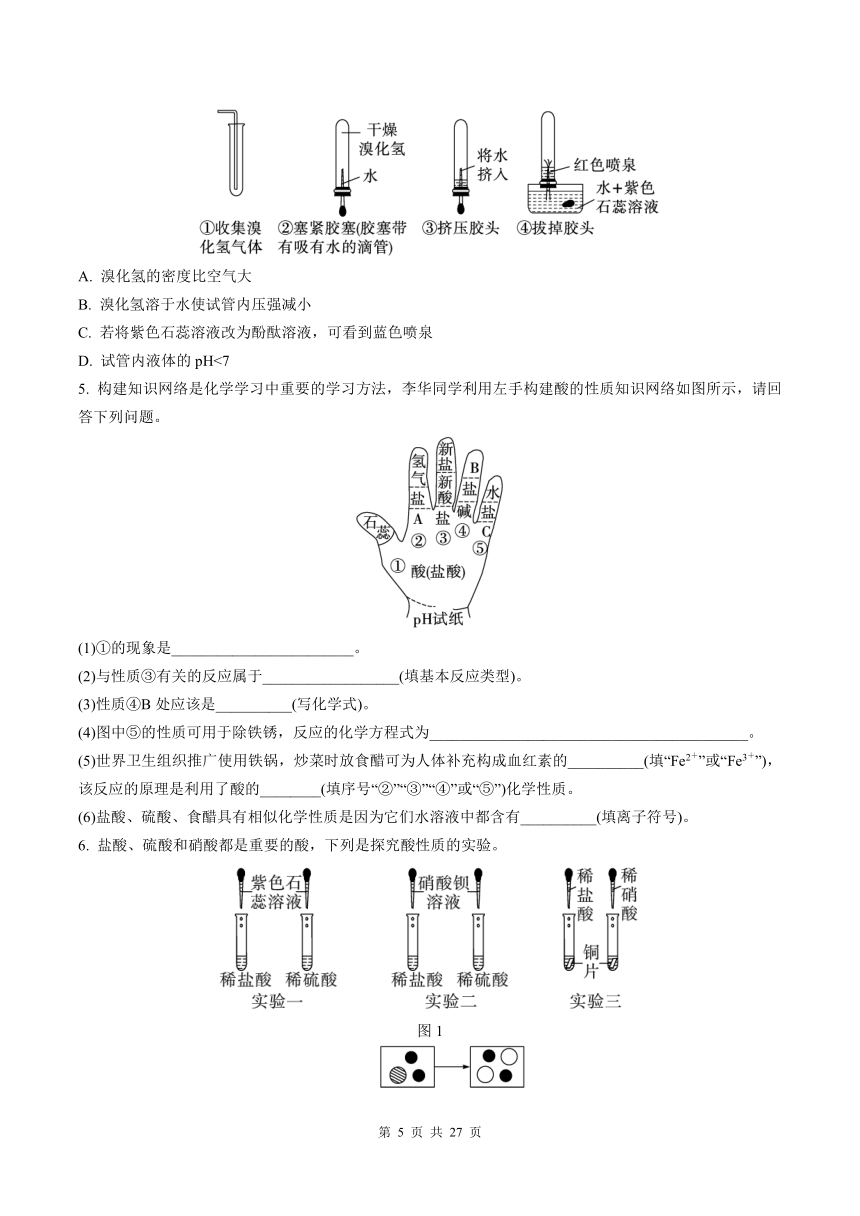
4. 已知:氯化氫(HCl)的水溶液是鹽酸,溴化氫(HBr)的水溶液是氫溴酸,某化學小組為了探究溴化氫的性質,做了如圖所示的實驗:請根據如圖操作和相關現象分析,下列描述錯誤的是( )
A. 溴化氫的密度比空氣大
B. 溴化氫溶于水使試管內壓強減小
C. 若將紫色石蕊溶液改為酚酞溶液,可看到藍色噴泉
D. 試管內液體的pH<7
5. 構建知識網絡是化學學習中重要的學習方法,李華同學利用左手構建酸的性質知識網絡如圖所示,請回答下列問題。
(1)①的現象是________________________。
(2)與性質③有關的反應屬于__________________(填基本反應類型)。
(3)性質④B處應該是__________(寫化學式)。
(4)圖中⑤的性質可用于除鐵銹,反應的化學方程式為__________________________________________。
(5)世界衛生組織推廣使用鐵鍋,炒菜時放食醋可為人體補充構成血紅素的__________(填“Fe2+”或“Fe3+”),該反應的原理是利用了酸的________(填序號“②”“③”“④”或“⑤”)化學性質。
(6)鹽酸、硫酸、食醋具有相似化學性質是因為它們水溶液中都含有__________(填離子符號)。
6. 鹽酸、硫酸和硝酸都是重要的酸,下列是探究酸性質的實驗。
圖1
圖2
(1)能區分稀鹽酸和稀硫酸的是________(填“實驗一”或“實驗二”),此實驗中觀察到的現象是__________________________________________。
(2)若實驗二中稀硫酸和硝酸鋇溶液恰好完全反應,反應的化學方程式為______________________________。如圖2是裝有稀硫酸的試管中加入硝酸鋇溶液前后主要離子種類及個數比變化示意圖。則“”代表的離子是________(填離子符號)。
(3)實驗三稀鹽酸中無明顯現象,稀硝酸中的現象為銅片逐漸溶解,溶液變藍,并有氣泡產生,反應的化學方程式為3Cu+8HNO3===3Cu(NO3)2+2X↑+4H2O,則X的化學式為________________________。
命題點3 常見堿的性質及用途
1. 氫氧化鈉和氫氧化鈣是兩種常見的堿,下列說法正確的是( )
A. 溶解性:都易溶于水
B. (易錯易混)用途:都可用于改良酸性土壤
C. 保存:在空氣中易變質,都需密封保存
D. 鑒別:取樣后分別滴入酚酞溶液
2. 如圖是關于氫氧化鈉化學性質的思維導圖。
(1)性質①:酚酞溶液遇氫氧化鈉溶液顯紅色,能使酚酞溶液變紅的離子是__________。
(2)性質②:向滴有酚酞溶液的氫氧化鈉溶液中加入一定量稀硫酸,觀察到溶液變為無色,則此時溶液中溶質成分可能為__________________(填化學式)。
(3)性質③:寫出一個符合性質③的物質甲的化學式________________。
(4)性質④:下列鹽能與氫氧化鈉發生反應的是__________(填序號)。
A. CuSO4 B. MgCl2 C. Ba(NO3)2 D. NH4NO3
[教材知識逐點過]
1. 堿的概念:在水溶液中解離出的陰離子全部是______的化合物。
2. 氫氧化鈉和氫氧化鈣的性質及用途
氫氧化鈉(NaOH) 氫氧化鈣[Ca(OH)2]
俗名 火堿、①______、②______ ③______、消石灰
物理性質 白色固體,④______溶于水,溶于水時放出大量的熱 白色粉末狀固體,⑤______溶于水
暴露在空氣中的變化 易吸收水分而潮解,與⑥______反應而變質,溶液質量⑦______,固體質量⑧______ 與⑨______反應而變質,溶液質量⑩______,固體質量 ______
腐蝕性 強烈的腐蝕性 較強的腐蝕性
用途 作干燥劑;重要的化工原料;用來去除油污,是爐具清潔劑的主要成分 作建筑材料;改良 ________土壤;配制農藥波爾多液等
3. 其他常見的堿:氫氧化鉀(KOH)、氨水(NH3·H2O)、氫氧化銅等。
4. 堿的化學性質
化學性質 化學方程式及反應現象
與酸堿指示劑作用 能使紫色石蕊溶液變①__________,能使無色酚酞溶液變②__________
與非金屬氧化物反應 (堿+非金屬氧化物 ―→鹽+水) 氫氧化鈉與二氧化碳:③____________________(吸收二氧化碳); 氫氧化鈣與二氧化碳:④________________________(檢驗二氧化碳)
與酸反應 (堿+酸―→鹽+水) 氫氧化鈣與稀鹽酸:⑤________________________________________________________; 氫氧化鎂與稀鹽酸:⑥_________________________________________________________
與鹽反應(堿+鹽 ―→新鹽+新堿) 氫氧化鈣與硫酸銅: ⑦________________________________(配制農藥波爾多液); 現象:⑧___________________________________________
總結:氫氧化鈉與氫氧化鈣化學性質相似的原因是⑨___________________________
【備考補充】堿的化學性質不完全相同的原因是____________________;如氫氧化鈣與碳酸鈉反應:______________________________(填化學方程式),用于工業制取燒堿。
[構建物質網絡]
1. 請寫出下列物質的化學式
甲______________(可用于濕法煉銅)
乙______________(可用于制碳酸飲料)
2. 請寫出圖中對應標號的化學方程式[共性部分以Ca(OH)2為例]
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________;
④________________________________________________________________________。
[拓展訓練]
1. 運輸氫氧化鈉固體的包裝箱上張貼的標識是( )
A B C D
2. 將20 g KOH加入100 g水中,配制成溶液。下列說法錯誤的是( )
A. KOH在水中解離出K+和OH- B. 一個K+帶一個單位正電荷
C. 該溶液的溶質質量分數為20% D. 向該溶液中滴入酚酞指示劑,溶液變紅
項目學習小組在實驗室將樹葉放入溶質質量分數為10%的NaOH溶液中煮沸,葉肉變黃時取出,洗刷干凈后制成葉脈書簽,如圖甲所示。請回答第3題。
3. 下列與制作葉脈書簽項目有關的說法錯誤的是( )
A. NaOH溶液可以腐蝕葉肉
B. 制作過程涉及化學變化
C. 制作完成后廢液需回收處理
D. NaOH固體存放處應張貼如圖乙所示標志
4. 航天員艙外服內含有與氫氧化鈉性質相似的氫氧化鋰(LiOH),它不可能具有的化學性質是( )
A. 與二氧化碳反應 B. 與氧化鐵反應 C. 與稀硫酸反應 D. 與硫酸銅溶液反應
5.同學們對 NaOH展開了如下探究活動。
活動一:探究NaOH的化學性質
【查閱資料】 Mg(OH)2是難溶于水的白色固體。
(1)A試管中觀察到酚酞溶液變為紅色,說明氫氧化鈉溶液顯______性。向 A試管中繼續加入稀硫酸,觀察到________________________,由此證明 NaOH能與 H2SO4反應。
(2)B試管中無明顯現象。向該試管中再加入足量的________,觀察到有氣泡產生。
(3)C試管中出現白色沉淀,發生反應的化學方程式為__________________________________。
活動二:了解NaOH的制備
工業上,可以通過電解飽和食鹽水的方法獲得 NaOH,該反應的化學方程式為:2NaCl+2X 2NaOH+Cl2↑+H2↑,則 X的化學式為________。
活動三:測定 NaOH樣品的純度
工業制得的 NaOH中常含有一定量的 NaCl。同學們采用“沉淀法”對某 NaOH樣品的純度進行測定。實驗方案如下:
(1)判斷方案中 MgCl2溶液過量的化學方法是________________________________。
(2)稱量前需將濾渣洗滌、干燥,否則會導致測定結果________(填“偏大”“偏小”或“不變”)。
命題點4 中和反應
[知識逐點過]
概念 ①________和②________作用生成鹽和水
表達式 酸+堿―→鹽+水
實質 酸中的③________與堿中的④________結合生成⑤________
應用 a.農業上:調節土壤的酸堿性,如用⑥________改良酸性土壤 b.工業上:處理工廠廢水,如用熟石灰處理⑦________性廢水 c.醫學上:用于醫藥,如服用堿性物質(如氫氧化鋁)治療⑧______________
[教材實驗到重難考法]
實驗7 中和反應
例1 如圖1所示是甲、乙兩組同學探究酸堿中和反應的實驗操作圖,請回答下列問題:
[教材基礎要點鞏固]
【實驗原理】
(1)該實驗發生反應的化學方程式為__________________________。
【實驗現象及結論】
(2)向稀氫氧化鈉溶液中滴入幾滴無色酚酞溶液,溶液變為______色,再用膠頭滴管慢慢滴加稀鹽酸,并用玻璃棒不斷攪拌,當觀察到__________________,說明稀鹽酸與氫氧化鈉發生了反應。
【微觀實質】
(3)結合圖2從微觀角度分析該反應的實質是____________________________(用文字說明)。
[中考重難考法提升]
考法1 實驗藥品選擇
(4)甲組有同學認為可以更換試劑,通過酸和堿反應的現象即可直接證明酸堿中和反應發生,請寫出一組符合要求的酸和堿____________________________________。
考法2 異常現象
(5)同學們在實驗過程中出現了一些異常現象,對此進行如下分析:
①將稀鹽酸滴入稀氫氧化鈉溶液過程中,有氣泡產生,可能的原因是________________________________
________________________________________________。
②在做該實驗前忘記加入酚酞溶液,實驗過程中再加入酚酞溶液,發現溶液未變色,能否證明二者恰好完全反應,并說明理由______________________________________________。
考法3 數字化實驗
(6)乙組同學設計了圖3實驗研究稀鹽酸與氫氧化鈉溶液的反應過程中pH及溫度的變化,如圖4、5所示。
①結合圖4溶液pH的變化,可以判斷圖3中試劑A是________溶液。
②圖4曲線b點溶液中溶質是__________(填化學式)。
③圖5中V的數值為__________,通過圖5證明該反應是__________(填“吸熱”或“放熱”)反應。
[實驗拓展——反應前后溶質成分的探究]
例2 某小組同學在實驗時,向盛有氫氧化鈉溶液的燒杯中滴加一定量稀鹽酸后發現忘記滴加指示劑,同學們對所得溶液中溶質的成分產生了興趣,于是進行如下探究。
【提出問題】溶液中溶質的成分是什么?
【作出猜想】猜想1: ________
猜想2: NaCl和NaOH
猜想3: NaCl和HCl
猜想4: NaCl、HCl和NaOH
【交流討論】同學們討論后一致認為猜想4不合理,理由是__________________________。
【設計實驗】
實驗方案 實驗現象 實驗結論
①取少量燒杯中的溶液于試管中,加入幾滴酚酞溶液 無明顯現象 猜想______不成立
②取少量燒杯中的溶液于試管中,加入適量碳酸鈉溶液 _____________________ 猜想3成立
③取少量燒杯中的溶液于試管中,加入硝酸銀溶液 產生白色沉淀
【評價反思】
老師對同學們能用多種方法進行探究的活動過程給予肯定,同時指出通過實驗方案③不能得到猜想3成立的結論,請分析其中原因________________________。
【拓展延伸】(1)在分析反應后所得物質的成分時,除考慮生成物外,還需考慮____________________。
(2)從環保的角度考慮,對燒杯內反應后的溶液的處理方法是____________________________(寫一條)。
[方法指導] ↓ 明確物質的狀態,因為是對溶液中溶質成分的探究,故難溶物及氣體無需考慮
↓ 根據生成物一定有、反應物中可能有一種過量來思考,一般猜想有三種(假設D為沉淀或氣體或水): ①恰好完全反應:C ②A過量:C、A ③B過量:C、B
↓ ↓ 驗證猜想時首先確定要檢驗的物質:C是生成物、一定存在,無需檢驗 A現象A是否存在 B現象B是否存在 注:若生成物對反應物的檢驗造成干擾,則需要先除去生成物,再進行檢驗
[拓展訓練]
1. 判斷說法的正誤:氫氧化鈉具有堿性,常用于改良酸性土壤(2019.8D)( )
2. 取稀鹽酸與氫氧化鈉反應后的溶液進行實驗,下列能說明兩者恰好完全反應的是( )
A. 加氫氧化銅固體生成藍色溶液
B. 加入鎂粉,沒有氣體生成
C. 測得該溶液的 pH=7
D. 滴入酚酞試液,溶液顯紅色
3. 常溫下,將10 mL 5%NaOH溶液逐滴加入盛有5 mL 5%稀鹽酸(含2滴酚酞)的錐形瓶中,邊滴邊振蕩。下列有關說法正確的是( )
A. 滴加過程中,錐形瓶內溶液中Na+的數目不斷增加
B. 滴加過程中,溶液恰好由無色變為紅色時,溶液pH為7
C. 滴加過程中,錐形瓶內溶液溫度不斷升高
D. 滴加結束后,取少量溶液蒸干,所得白色固體是NaCl
4. 某化學興趣小組三位同學在學習了硫酸與氫氧化鈉反應后,分別結合自己在實驗室中所做的實驗,從不同方面對其進行圖象描述。圖 A是實際操作圖,圖 B是反應過程中溶液的酸堿度變化圖,圖 C是微觀粒子結合過程的示意圖。
根據以上圖示,回答下列問題:
(1)依據圖A、圖B可知,該實驗是將____________滴加到另一種溶液中。
(2)圖B中b點溶液中溶質是________________。
(3)向pH=7的溶液中滴加氯化鋇,發生反應的化學方程式為____________________________。
(4)寫出圖C中方框內乙粒子的符號________。
命題點5 常見鹽的性質及用途 化肥
1. 下列有關鹽的說法正確的是( )
A. 所有的鹽溶液pH都等于7
B. 鹽都能溶于水
C. 鹽中不一定含有金屬元素
D. 亞硝酸鈉有咸味,可以代替食用鹽
2. (易錯易混)振興鄉村,發展農業生產,化肥起著重要作用。下列關于化肥的說法正確的是( )
A. 如果農作物出現倒伏現象,說明缺少氮元素,應施加氮肥
B. 用觀察外觀的方式可區分硫酸銨和磷礦粉兩種化肥
C. 用熟石灰與某化肥一起研磨,聞到刺激性氣味,該化肥不一定是銨態氮肥
D. 化肥和農藥對農業增產有著重要的作用,因此應大量使用
3. 為探究碳酸鈉的化學性質,興趣小組的同學進行了以下實驗,請回答下列問題。
(1)A試管中觀察到溶液變紅,說明碳酸鈉溶液顯__________(填“酸”“堿”或“中”)性。
(2)B試管中觀察到的現象是________________________________。
(3)C試管中發生反應的化學方程式為______________________________________。
(4)選擇A試管內的藥品,設計實驗證明反應后D試管中的BaCl2溶液過量___________________________
_______________________________(寫出實驗操作和現象)。
[知識逐點過]
一、常見鹽的性質及用途
1. 鹽的概念:指一類組成里含有__________(或銨根離子)和__________的化合物。
2. 常見鹽的性質和用途
常見的鹽 氯化鈉(NaCl) 碳酸鈉(Na2CO3) 碳酸氫鈉(NaHCO3) 碳酸鈣(CaCO3)
俗名或主要成分 ①________的主要成分 ②________ ③________ ④________ ⑤__________的主要成分
性質 白色晶體,易溶于水 白色固體,易溶于水 白色固體,能溶于水 白色固體,⑥____溶于水
用途 調味品、融雪劑、配制生理鹽水等 用于玻璃、造紙、紡織等 焙制糕點、治療胃酸過多癥等 建筑材料、補鈣劑等
3. 鹽的化學性質
化學性質 化學方程式及現象
與金屬反應 通式:鹽+金屬―→新鹽+新金屬 硫酸銅和鐵:①________________; 現象:②______________________________________________________________
與酸反應 通式:鹽+酸―→新鹽+新酸 碳酸鈣和稀鹽酸:③________________; 現象:④______________________________________________________________
與堿反應 通式:鹽+堿―→新鹽+新堿 硫酸銅和氫氧化鈣:⑤________________; 現象:⑥_______________________________________________________________
與鹽反應 通式:鹽1+鹽2―→新鹽1+新鹽2 碳酸鈉和氯化鈣:⑦________________; 現象:⑧_______________________________________________________________
二、化肥
1. 化肥的種類及作用
種類 概念 主要作用
氮肥 只含營養元素(氮、磷、鉀)中①____元素的化肥,如硝酸銨(NH4NO3) 壯葉(葉色濃綠)
磷肥 只含營養元素(氮、磷、鉀)中②____元素的化肥,如磷礦粉[Ca3(PO4)2] 壯果(增強作物的抗寒、抗旱能力)
鉀肥 只含營養元素(氮、磷、鉀)中③____元素的化肥,如氯化鉀(KCl) 壯莖(增強抗病蟲害和抗倒伏能力)
復合肥 同時含有氮、磷、鉀中的兩種或三種營養元素的化肥,如硝酸鉀(KNO3) 多元肥效
2. 化肥的簡易鑒別(“一看、二溶、三聞”)
氮肥 鉀肥 磷肥
看外觀 白色晶體 灰白色粉狀
加水 全部溶于水 大多不溶或部分溶于水
加熟石灰研磨 銨態氮肥___________ 無刺激性氣味氨氣放出
3. 使用化肥和農藥的利與弊
利 使農作物高產豐收,降低病蟲害
弊 過量使用易引起環境污染、對人體健康造成危害,如土壤酸化或退化、水體富營養化等
[構建物質網絡]
一、以含鈉物質為中心的反應與轉化
1. 請寫出圖中對應標號的化學方程式
②________________________________________________________________________;
③________________________________________________________________________;
⑤________________________________________________________________________;
⑧________________________________________________________________________。
圖中涉及的反應有沉淀生成的是__________(填序號)。
二、含鈣化合物之間的轉化
1. 請寫出下列物質的化學式
甲__________ 乙____________
2. 請寫出圖中對應標號的化學方程式
①________________________________________________________________________;
③________________________________________________________________________;
⑥________________________________________________________________________。
[拓展訓練]
1. 發明聯合制堿法,為純堿工業發展作出杰出貢獻的是( )
A. 張青蓮 B. 侯德榜 C. 拉瓦錫 D. 道爾頓
2. 荔枝生長過程中,需要施肥為果樹補充營養。下列屬于復合肥的是( )
A. NH4H2PO4 B. CO(NH2)2 C. NH4NO3 D. KCl
3. 如圖是某番茄無土栽培營養液的配方,其中屬于磷肥的是( )
A. MgSO4
B. Ca(NO3)2
C. KNO3
D. NH4H2PO4
番茄無土栽培營養液配方(用量單位:mg/L)
MgSO4 Ca(NO3)2 KNO3 NH4H2PO4 H3BO3
492 590 606 153 2.86
4. 化學肥料是農作物的“糧食”。下列關于化學肥料的說法正確的是( )
A. 尿素[CO(NH2)2]屬于復合肥料
B. 大量施用化肥以提高農作物產量
C. 銨態氮肥與草木灰混用,會降低肥效
D. 棉花葉片枯黃,應施用硫酸鉀等鉀肥
5. 幸福需要辛勤的勞動來創造。下列勞動項目與所涉及的化學知識不相符的是
( )
選項 勞動項目 化學知識
A 用發酵粉焙制糕點 NaHCO3能產生CO2
B 用布擦干淋濕的自行車 鐵部件潮濕易生銹
C 施用碳酸氫銨化肥后,應及時蓋土 碳酸氫銨不穩定
D 清理家中魚缸并通入空氣 空氣中的氧氣易溶于水
6. 學習了單質、氧化物、酸、堿、鹽的性質后,發現有很多不同類別的物質在發生反應時都有鹽生成(其他物質省略),如圖所示。請回答:
(1)若鹽是硫酸鉀,則①中發生反應的化學方程式為________________________________。
(2)若鹽是氯化亞鐵,則在已顯示的變化中可以通過置換反應來實現的有______(填序號)。
(3)若鹽是硝酸銅,由⑦來實現的化學方程式為:__________________________________。
(4)圖中⑤處應補充的文字是________________(寫一種,不能與圖中已有信息重復)。
7. 碳酸氫鈉(NaHCO3)俗稱小蘇打,是發酵粉的主要成分,也可用于治療胃酸過多。以下關于碳酸氫鈉性質的描述中,屬于物理性質的是( )
A. 受熱易分解
B. 白色固體,可溶于水
C. 水溶液呈堿性
D. 能與鹽酸反應產生二氧化碳
8. 波爾多液是農業上常用的一種殺菌劑,由硫酸銅、生石灰和水配制而成,因1885年首先用于法國波爾多城而得名。下列關于配制波爾多液的敘述錯誤的是( )
A. 選用鐵制容器配制波爾多液
B. 配制波爾多液時有熱量放出
C. 配制波爾多液時有藍色沉淀產生
D. 波爾多液的主要成分是氫氧化銅和硫酸鈣
9. 及時歸納是學好化學的主要方法之一。利用如圖所示的結構圖歸納鹽的四個方面的化學性質(圖中編號①~④),請歸納有關知識。
(1)若驗證性質①時,某些金屬選用鐵,鹽選用硫酸銅溶液,二者反應的化學方程式為____________________________,能觀察到________________________。
(2)在歸納性質②時,選取了硫酸銅和氫氧化鈉兩種物質,它們在溶液中相互反應時產生的現象是____________________,化學方程式為____________________________________。
(3)在性質③中,X代表________類物質。
(4)在歸納性質④時,從“某些鹽”中選取了硝酸銀,寫出與硝酸銀反應的物質的化學式________(寫一個)。
10. 已知銨態氮肥能與堿反應,放出有強烈刺激性氣味的氨氣。現有氨水、碳酸氫銨、硫酸銨[(NH4)2SO4]、氯化銨(NH4Cl)、硝酸銨(NH4NO3)、尿素[CO(NH2)2]六種氮肥:
(1)在上述六種化肥中,________呈液態,碳酸氫銨有強烈的氨味,據此可直接將它們與其他四種氮肥相區別。
(2)其他四種氮肥的鑒別方法如右圖所示。寫出氮肥B與硝酸鋇溶液反應的化學方程式:________________________________________。
(3)在A、B、C、D四種氮肥中,含氮量最高的是________。
11. 純堿在工業生產中用途極廣,廣泛應用于冶金、造紙、紡織、印染和洗滌劑生產等領域。某化學興趣小組的同學在預習了純堿的相關知識后,對純堿的制備和部分化學性質展開項目式學習,并對部分實驗廢液進行了拓展探究。
任務一:了解純堿的制備——“侯氏制堿法”
“侯氏制堿法”的主要過程是利用飽和食鹽水先后吸收兩種氣體,生成碳酸氫鈉和氯化銨,再加熱碳酸氫鈉即可制得純堿。
“侯氏制堿法”的主要過程中需要吸收的兩種氣體是________(填字母序號)。
A. Cl2 B. NH3 C. SO2 D. CO2
任務二: 探究純堿與酸、堿、鹽的反應
向盛有一定量純堿溶液的三支試管中分別加入稀鹽酸、澄清石灰水、氯化鋇溶液,實驗現象記錄如下:
試管編號 1 2 3
加入試劑 稀鹽酸 澄清石灰水 氯化鋇溶液
實驗現象 ________ 產生白色沉淀 產生白色沉淀
任務三:對部分廢液的拓展探究
化學興趣小組的同學將實驗后試管2和試管3中的物質分別進行過濾,得到濾液甲和濾液乙。
【提出問題】濾液乙中的溶質是什么?
【猜想與假設】猜想一:氯化鈉;猜想二:氯化鈉和碳酸鈉;猜想三:________________。
【進行實驗】
實驗操作 實驗現象 實驗結論
取少量濾液乙于試管中,加入適量稀硫酸 ____________ 猜想三成立
【拓展延伸】基于以上探究結論,同學們取一定量的濾液甲和濾液乙于小燒杯中混合,發現有白色沉淀產生,試寫出該反應的化學方程式__________________________________________。
命題點6 復分解反應及共存
[知識逐點過]
一、復分解反應
定義 由兩種__________互相交換成分,生成另外兩種________的反應
條件 a. 反應物無酸,兩種反應物都必須可溶;反應物有酸,另一種反應物可不溶 b. 有________或________或________生成
表達式 AB+CD ―→ AD+CB
二、物質的共存
1. 共存的條件:在同一溶液中,物質(即構成物質的離子)之間不會結合生成氣體或沉淀或水。
2. 解答物質共存的方法
(1)明確共存條件:①組內物質可溶;②物質(或離子)結合不會生成沉淀或氣體或水;③溶液呈電中性(同時含有陰離子和陽離子)。
(2)分析題給條件確定隱含條件:①溶液呈酸性或pH<7―→含有______ (寫離子符號,后同);②溶液呈堿性或pH>7―→含有______;③溶液顯色:黃色―→含有______;淺綠色―→含有______;藍色―→含有______。
(3)分析組內所給離子能否共存
[拓展訓練]
1. 下列各組物質在溶液中能夠大量共存的是( )
A. BaCl2 NaCl CuCl2
B. HCl AgNO3 NaNO3
C. H2SO4 NaOH KNO3
D. K2CO3 Ba(OH)2 KCl
2. 下列物質在指定環境下能共同存在的是( )
A. 有CO存在的溶液中:NaCl、Ca(OH)2、NaHCO3
B. 澄清、無色溶液中:MgCl2、Ba(OH)2、KNO3
C. pH=1的溶液中:BaCl2、NaNO3、NH4Cl
D. 能使酚酞變紅色的溶液中:CuCl2、K2SO4、NaNO3
3. 某校化學興趣小組的同學利用稀鹽酸、碳酸鈉、Ba(OH)2溶液三種物質探究“復分解反應發生的條件”,做了以下實驗。
(1)大家一致認為在試管①中還需要加入________溶液才能證明發生了復分解反應。
(2)試管②中觀察到的現象是________,試管③中反應的化學方程式為________________。
(3)通過三組實驗,同學們得出復分解反應發生的條件是________________。
命題點7 粗鹽提純
實驗8 粗鹽提純
例1 如圖1是某實驗小組用含泥沙的粗鹽進行粗鹽中難溶性雜質去除的部分實驗操作示意圖,請回答下列問題。
圖1
圖2
[教材基礎要點鞏固]
【實驗原理】
(1)該實驗利用了氯化鈉與泥沙在水中__________不同的性質。
【實驗用品】
(2)托盤天平、量筒、燒杯、鐵架臺、漏斗、藥匙、蒸發皿、______、玻璃棒、坩堝鉗、粗鹽、濾紙、火柴等。
【實驗步驟】
(3)溶解:稱量一定質量粗鹽放入燒杯中,加水溶解并用________不斷攪拌,至粗鹽不再溶解,稱量剩余粗鹽,計算得到加入燒杯中的粗鹽質量為m g。
(4)過濾:制作過濾器的過程如圖2所示,正確的操作順序是__________(填字母)。
(5)蒸發:蒸發結晶過程中,當觀察到____________________時,停止加熱,利用余熱將濾液蒸干。
(6)計算產率:將蒸發得到的精鹽轉移到濾紙上,稱其質量為n g,產率=×100%=________(寫出計算式)。
【實驗反思】
(7)提純后的精鹽屬于______(填“純凈物”或“混合物”)。
(8)該實驗中關于玻璃棒的用途錯誤的是__________(填字母)。
A. 溶解時攪拌,加速粗鹽溶解
B. 過濾時攪拌,加快過濾速度
C. 蒸發時攪拌,防止局部溫度過高液滴飛濺
D. 稱量精鹽前,把精鹽固體轉移到紙上
(9)實驗過程中有些同學在過濾后發現濾液仍渾濁,可能的原因是 ______________(寫一條)。
[中考重難考法提升]
考法1 偏差分析
(10)小組同學在計算產率時若發現計算結果偏大,可能的原因是________(填字母序號,后同),若發現計算結果偏小,可能的原因是________。
a. 稱量精鹽時“左碼右物”,且使用了游碼
b. 過濾時有液體濺出
c. 過濾時漏斗內液面超過濾紙邊緣
d. 濾紙破損
e. 蒸發時沒有攪拌,有液體濺出
f. 蒸發結晶時未充分蒸干
g. 從蒸發皿中轉移固體時,固體撒落
考法2 解決實際問題
(11)[真實問題情境]生活在鹽堿湖附近的人們可以通過“夏天曬鹽”的方式獲取食鹽,“曬鹽”是通過__________(填“蒸發結晶”或“降溫結晶”)的方法獲取食鹽。
考法3 實驗探究方法
通過粗鹽中難溶性雜質的去除實驗,構建出混合物分離的思維模型如下:
(12) 海水淡化是將海水中的鹽與水分開,常壓加熱蒸餾法是其中的一種:常壓下將海水加熱形成水蒸氣,再液化得到淡水的過程。海水加熱形成水蒸氣屬于上述模型中的______________(填“物理分離”或“反應轉化”)。
[實驗拓展——粗鹽中可溶性雜質的去除]
例2 如圖是同學們進行粗鹽中可溶性雜質去除的實驗流程圖。
【試劑選擇】
(1)實驗前根據雜質離子對除雜試劑進行選擇,老師給出了下列框圖,請補充完整:
【實驗分析】
(2)步驟Ⅰ、Ⅱ中加入過量NaOH和Y溶液后,充分攪拌、過濾,得到的濾渣成分為__________。
(3)加入過量Z溶液發生反應的化學方程式為____________________________(任寫一個)。
(4)分離出沉淀后,步驟Ⅳ中加入適量稀鹽酸的作用是___________________________________。
【實驗反思】
(5)如果加入的稀鹽酸過量,對最終得到的氯化鈉的純度__________(填“有”或“無”)影響,原因是________________________________________________。
【實驗拓展】
(6)[試劑替代]步驟Ⅰ和Ⅱ中的試劑可用一種試劑代替,該試劑的名稱是____________。
(7)[偏差分析]同學們稱得除雜后所得精鹽的質量大于粗鹽的質量,造成該結果的原因可能是______(填序號)。
A. 蒸發時有水分沒有蒸干
B. 除雜過程中有氯化鈉生成
C. 溶解時粗鹽沒有溶解完全
[拓展訓練]
1. 實驗室對含有MgCl2的粗鹽進行提純,步驟如圖:
(1)步驟①中, 稱量5.0 g粗鹽需補充的主要儀器是__________________。
(2)步驟②中,玻璃棒的作用是__________________。
(3)步驟③中,滴加過量NaOH溶液除去MgCl2,反應的化學方程式是________________________________________________________________________。
(4)步驟⑤中,為中和過量的NaOH,應滴加的“試劑a”是________(填字母)。
A. 稀鹽酸 B. 稀硫酸 C. 稀硝酸
(5)步驟⑥的操作名稱是__________,當____________________時,停止加熱。
2. 在“粗鹽中難溶性雜質的去除”實驗中,下列裝置和操作正確的是( )
3. 隋末唐初的“五步產鹽法”被列入國家級非物質文化遺產目錄,該法以集鹵蒸發、過“籮”除雜、儲鹵、結晶、鏟出五個生產步驟來制得粗鹽。下列說法錯誤的是( )
A. 集鹵蒸發后所得溶液為氯化鈉飽和溶液
B. 過“籮”除雜相當于現代除雜中的過濾
C. 結晶的過程中會有大量的固體析出
D. 現代生產用KOH溶液除去粗鹽中的MgCl2
4. 制鹽在我國有著悠久的歷史。某鹽湖水樣品含有NaCl、Na2SO4及少量 MgSO4和CaSO4,某小組從中獲取NaCl和Na2SO4的主要過程如下:
(1)“除雜1”應依次加入的兩種試劑是________、________,“除雜2”應加入的試劑是________。[除雜限選試劑:HCl、HNO3、Na2CO3、Ca(OH)2]
(2)將“溶液A”在80 ℃蒸發濃縮,至有少量固體析出。
①該小組分析溶解度曲線,推測析出的少量固體是NaCl,但檢驗后卻發現是Na2SO4。請作出合理解釋:________________________________________________________。
②該小組停止蒸發濃縮,經________、過濾得到大量Na2SO4固體及母液;將母液中的NaCl分離出來,操作是______________________。
(3)設計由硫磺(單質硫)生產Na2SO4的轉化路徑,依次寫出反應的化學方程式:__________________________________________。(提示:常見+4價硫的化合物可與O2化合為+6價硫的化合物)
第6講
命題點1
1.C 2.D
知識逐點過
1.紅 藍 無 紅
2.①pH試紙 ②酸堿度 ③增強 ④中性 ⑤增強 ⑥5.6
[拓展訓練]
1.C 2.D
3.將pH試紙放在玻璃片上,用玻璃棒蘸取待測液滴在pH試紙上,待顯色后與標準比色卡進行對比讀數 稀鹽酸
4.C 5. A
命題點2
1.C
2.(1)溶液變紅 (2)CuO(或氧化銅) Fe2O3+6HCl=== 2FeCl3+3H2O (3)復分解反應
(4)鋅(或Zn)(合理即可) 將生成的氣體通入澄清石灰水中
知識逐點過
1.氫離子(或H+) 2.揮發 干燥劑 4.干燥劑
5.①紅 ②2HCl+Fe ===FeCl2+H2↑ ③有氣泡產生,溶液由無色變為淺綠色 ④6HCl+Fe2O3 === 2FeCl3+3H2O ⑤紅棕色固體溶解,溶液由無色變為黃色
⑥HCl+NaOH === NaCl+H2O ⑦H2SO4+Na2CO3 === Na2SO4+H2O+CO2↑ ⑧固體逐漸溶解,有氣泡產生 ⑨2HCl+CaCO3=== CaCl2+H2O+CO2↑
⑩在水溶液中解離出的陽離子都是H+
【備考補充】HCl+AgNO3===AgCl↓+HNO3 H2SO4+BaCl2=== BaSO4↓+2HCl 產生白色沉淀 產生白色沉淀 酸中含有的陰離子不同
構建物質網絡
1.AgNO3 NaOH
2.①Zn+2HCl === ZnCl2+H2↑
②HCl+NaOH === NaCl+H2O
③2HCl+Na2CO3=== 2NaCl+H2O+CO2↑
④CuO+2HCl=== CuCl2+H2O
⑤H2SO4+BaCl2=== BaSO4↓+2HCl
⑥HCl+AgNO3=== AgCl↓+HNO3
[拓展訓練]
1.C 2.B 3.B 4.C
5.(1)石蕊溶液變紅 (2)復分解反應 (3)H2O
(4)Fe2O3+6HCl=== 2FeCl3+3H2O (5)Fe2+ ② (6)H+
6.(1)實驗二 稀鹽酸中無明顯現象,稀硫酸中產生白色沉淀
(2)Ba(NO3)2+H2SO4=== BaSO4↓+2HNO3 H+(3)NO
命題點3
1.C
2.(1)氫氧根離子(或OH-) (2)Na2SO4或Na2SO4、H2SO4 (3)CO2(合理即可) (4)ABD
知識逐點過
1.氫氧根離子(或OH-)
2.①燒堿 ②苛性鈉(可與前一空互換) ③熟石灰 ④易 ⑤微 ⑥二氧化碳(或CO2) ⑦增大 ⑧增大 ⑨二氧化碳(或CO2) ⑩減小 增大
酸性
4.①藍 ②紅 ③2NaOH+CO2=== Na2CO3+H2O
④Ca(OH)2+CO2=== CaCO3↓+H2O
⑤Ca(OH)2+2HCl===CaCl2+2H2O ⑥Mg(OH)2+2HCl===MgCl2+2H2O
⑦Ca(OH)2+CuSO4=== Cu(OH)2↓+CaSO4 ⑧產生藍色沉淀,溶液由藍色變為無色 ⑨在水溶液中解離出的陰離子全都是OH-
【備考補充】堿中含有的陽離子不同 Ca(OH)2+Na2CO3=== CaCO3↓+2NaOH
構建物質網絡
1.CuSO4 CO2
2.①H2SO4+Ca(OH)2=== CaSO4+2H2O(或2HCl+Ca(OH)2=== CaCl2+2H2O)
②CuSO4+Ca(OH)2=== Cu(OH)2↓+CaSO4
③CO2+Ca(OH)2=== CaCO3↓+H2O
④Ca(OH)2+Na2CO3=== CaCO3↓+2NaOH
[拓展訓練]
1.A 2.C 3.D
4.B
5.活動一:(1)堿 溶液由紅色逐漸變為無色 (2)稀鹽酸(合理即可) (3)MgCl2+2NaOH=== Mg(OH)2↓+2NaCl
活動二:H2O
活動三:(1)取反應后的上層清液,滴加氫氧化鈉溶液,若有白色沉淀生成則說明氯化鎂溶液已過量(合理即可) (2)偏大
命題點4
教材知識逐點過
①酸 ②堿 ③氫離子(或H+) ④氫氧根離子(或OH-) ⑤水分子(或H2O) ⑥熟石灰 ⑦酸
⑧胃酸過多癥
教材實驗到重難考法
例1 (1)HCl+NaOH=== NaCl+H2O (2)紅 溶液由紅色變為無色 (3)氫離子與氫氧根離子結合生成水分子 (4)氫氧化銅與稀鹽酸(合理即可) (5)①氫氧化鈉溶液變質,生成了碳酸鈉 ②不能,若鹽酸過量,也會發現溶液未變色 (6)①氫氧化鈉 ②NaCl ③40 放熱
例2 【作出猜想】NaCl 【交流討論】HCl和NaOH在溶液中不能共存 【設計實驗】①2 ②有氣泡產生 【評價反思】氯化鈉也能與硝酸銀溶液反應產生白色沉淀,不能證明溶液中一定存在HCl 【拓展延伸】(1)反應物的用量 (2)加入堿性溶液使其呈中性(合理即可)
[拓展訓練]
1.×
2.C 3.A
4.(1)硫酸(或H2SO4) (2)NaOH、Na2SO4(或氫氧化鈉、硫酸鈉) (3)BaCl2+Na2SO4 === BaSO4↓+2NaCl
(4)SO
命題點5
1.C 2.B
3.(1)堿 (2)有氣泡產生 (3)Ca(OH)2+Na2CO3=== CaCO3↓+2NaOH
(4)取D試管內上層清液少許,滴加到A試管中,若產生白色沉淀,則證明反應后D試管中BaCl2溶液過量
知識逐點過
一、1.金屬離子 酸根離子
2.①食鹽 ②純堿 ③蘇打(可與前一空互換) ④小蘇打 ⑤大理石(或石灰石) ⑥不
3.①CuSO4+Fe=== Cu+FeSO4 ②有紅色固體析出,溶液由藍色變為淺綠色 ③CaCO3+2HCl=== CaCl2+H2O+CO2↑ ④固體逐漸溶解,有氣泡產生
⑤CuSO4 +Ca(OH)2=== Cu(OH)2↓+CaSO4
⑥產生藍色沉淀,溶液由藍色變為無色 ⑦Na2CO3 +CaCl2=== 2NaCl +CaCO3↓ ⑧產生白色沉淀
二、1.①氮(或N) ②磷或(P) ③鉀(或K)
2.放出具有刺激性氣味的氣體
構建物質網絡
一、1.②2HCl+Na2CO3=== 2NaCl+H2O+CO2↑
③Ba(OH)2+Na2CO3=== BaCO3↓+2NaOH
⑤2NaHCO3+H2SO4=== Na2SO4+2H2O+2CO2↑
⑧AgNO3+NaCl=== NaNO3+AgCl↓
2.③④⑦⑧
二、1.CaCO3 CaO
2.①CaCO3 CaO+CO2↑
③CO2+Ca(OH)2=== CaCO3↓+H2O(合理即可)
⑥2HCl+Ca(OH)2=== CaCl2+2H2O(合理即可)
[拓展訓練]
1.B 2.A 3.D 4.C 5.D
6 (1)2KOH+H2SO4=== K2SO4+2H2O (2)④⑥
(3)Ba(NO3)2+CuSO4=== Cu(NO3)2+BaSO4↓[或2AgNO3+CuCl2=== Cu(NO3)2+2AgCl↓] (4)金屬氧化物+酸(或非金屬氧化物+堿)
7.B 8.A
9.(1)Fe+CuSO4=== FeSO4+Cu 鐵表面有紅色固體析出,溶液由藍色變為淺綠色 (2)產生藍色沉淀 2NaOH+CuSO4=== Na2SO4+Cu(OH)2↓ (3)酸 (4)NaCl(或KCl等,合理即可)
10.(1)氨水 (2)(NH4)2SO4+Ba(NO3)2 === BaSO4 ↓+2NH4NO3 (3)A
11.任務一:BD 任務二:有氣泡產生
任務三:【猜想與假設】氯化鈉和氯化鋇 【進行實驗】產生白色沉淀 【拓展延伸】BaCl2+Na2CO3=== 2NaCl+BaCO3↓
命題點6
知識逐點過
一、化合物 化合物 水 氣體 沉淀(可與前兩空互換)
二、2.(2)①H+ ②OH- ③Fe3+ Fe2+ Cu2+
拓展訓練
1.A 2.C
3.(1)無色酚酞(或紫色石蕊)
(2)固體逐漸溶解,有氣泡產生 Ba(OH)2+Na2CO3 === BaCO3↓+2NaOH (3)有沉淀或氣體或水生成
命題點7
教材實驗到重難考法
例1 (1)溶解性 (2)酒精燈 (3)玻璃棒 (4)cab (5)蒸發皿中有較多固體析出 (6) ×100% (7)混合物 (8)B (9)濾紙破損(或液面高于濾紙邊緣或盛接濾液的儀器不干凈等,合理即可)
(10)acdf beg (11)蒸發結晶 (12)物理分離
例2 (1)BaCl2 Na2CO3 (2)Mg(OH)2、BaSO4
(3)Na2CO3+BaCl2 === BaCO3 ↓+2NaCl(或Na2CO3+CaCl2 === CaCO3 ↓+2NaCl) (4)除去過量的碳酸鈉和氫氧化鈉 (5)無 鹽酸易揮發,過量的鹽酸會在蒸發時被除去 (6)氫氧化鋇溶液 (7)AB
[拓展訓練]
1.(1)天平(或托盤天平或電子天平) (2)攪拌,加速溶解 (3)2NaOH+MgCl2 === 2NaCl+Mg(OH)2↓ (4)A (5)蒸發 蒸發皿中出現較多固體
2.D 3. D
4.(1)Ca(OH)2 Na2CO3 HCl (2)①80 ℃時,Na2SO4和NaCl的溶解度相近,該鹽湖水中Na2SO4含量比NaCl高,蒸發濃縮時Na2SO4先達到飽和狀態而析出(合理即可) ②降溫結晶(或冷卻熱飽和溶液) 蒸發結晶、趁熱過濾、洗滌、干燥 (3)S+O2 SO2、2SO2+O2 2SO3、SO3+2NaOH=== Na2SO4+H2O(或S+O2 SO2、SO2+2NaOH=== Na2SO3+H2O、2Na2SO3+O2=== 2Na2SO4,合理即可)
展開更多......
收起↑
 資源預覽
資源預覽