資源簡介
資源簡介
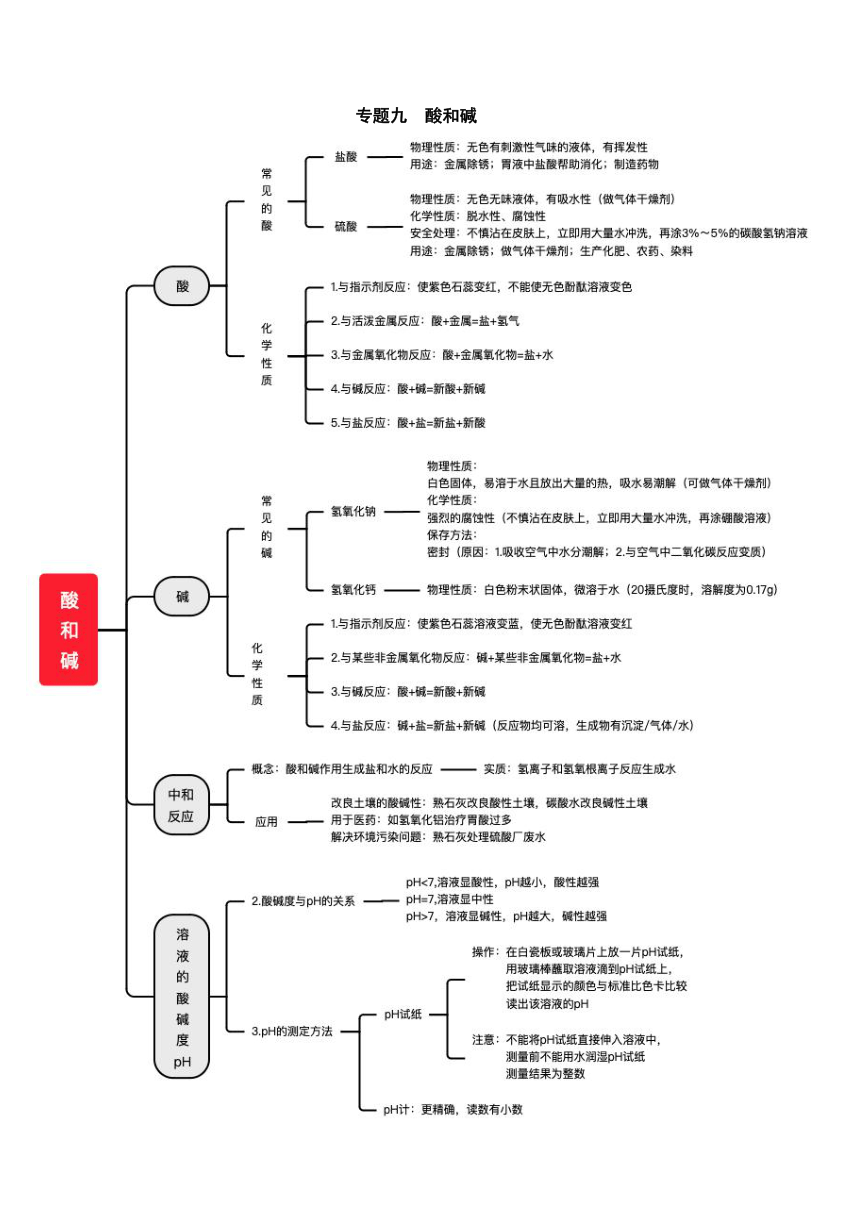
專題九 酸和堿
酸堿指示劑
1.概念:能跟酸或堿的溶液起作用而顯示不同顏色的物質叫酸堿指示劑。
2.顯色規律及應用
酸堿指示劑 酸性溶液 中性溶液 堿性溶液 變色規律
紫色石蕊溶液 紅色 紫色 藍色 酸紅堿藍
無色酚酞溶液 無色 無色 紅色 遇堿變紅
常見的酸
1.酸的定義:物質溶于水時,形成的陽離子全部是H+的化合物。
2.常見的酸:硫酸(H2SO4)、硝酸(HNO3)、醋酸(CH3COOH)、碳酸(H2CO3)等
3.鹽酸和硫酸比較
濃硫酸 H2SO4 濃鹽酸 HCl
色、態、味 無色黏稠的油狀液體、無味 無色的液體、有刺激性氣味
揮發性 無 有
吸水性 具有吸水性(物理性質) 不具有吸水性
用途 重要化工原料。用于生產化肥、農藥、火藥、染料以及冶煉金屬、精煉石油和金屬除銹等。 濃硫酸有吸水性,在實驗室中常用它做干燥劑。 重要化工產品。用于金屬表面除銹、制造藥物(如鹽酸麻黃素、氯化鋅)等;人體胃液中有鹽酸,可幫助消化。
(1)濃硫酸腐蝕性脫水性(化學性質):
它能奪取紙張、木材、布料、皮膚(都由含碳、氫、氧等元素的化合物組成)里的水分,生成黑色的炭。
(2)安全處理:不慎將濃硫酸沾到皮膚或衣服上,應立即用大量水沖洗,然后涂上3%~5%的碳酸氫鈉溶液。稀硫酸沾在衣服上,水分蒸發后會變成濃硫酸,也要進行處理。
(3)濃硫酸的稀釋
正確操作 操作要領: 酸入水,沿器壁,慢傾倒,及時攪; *濃硫酸溶于水放出大量熱 錯誤操作 水倒入酸中放出大量熱使水沸騰,酸液飛濺 *切不可把水注入濃硫酸!
酸的化學性質
1.酸有相同的化學性質是因為酸在水中都能電離出H+。
2.酸的化學性質
①+酸堿指示劑 紫色石蕊溶液變紅,無色酚酞不變色 使用點滴板進行實驗優點: 操作簡單、節約藥品、 便于對照、效果較好。
②+活潑金屬 (置換反應) 鐵和酸反應: Fe+2HCl=FeCl2+H2↑ Fe+H2SO4=FeSO4+H2↑ 現象:鐵表面有氣泡產生;溶液由無色逐漸變為淺綠色 鋅和酸反應: Zn+2HCl = ZnCl2+H2↑ Zn+H2SO4 = ZnSO4+H2↑ 現象:固體逐漸溶解,產生氣泡
③+金屬氧化物 (復分解反應) 氧化鐵和酸反應: Fe2O3+6HCl = 2FeCl3+3H2O Fe2O3+3H2SO4 = Fe2(SO4)3+3H2O 現象:紅色固體逐漸溶解,溶液由無色變為黃色 氧化銅和酸反應: CuO+2HCl = CuCl2+H2O CuO+H2SO4 = CuSO4+H2O 現象:黑色固體逐漸溶解,溶液由無色變為藍色
④+堿 (中和反應) HCl與NaOH反應: HCl+NaOH = NaCl+H2O H2SO4與Ca(OH)2反應: H2SO4+Ca(OH)2 = CaSO4+2H2O
⑤+某些鹽 (復分解反應) HCl與CaCO3反應: 2HCl+CaCO3 = CaCl2+H2O+CO2↑ 現象:固體逐漸溶解,產生氣泡 H2SO4與Na2CO3反應: H2SO4+Na2CO3 = Na2SO4+H2O+CO2↑ 現象:產生大量氣泡
除硫酸鋇的鋇鹽都能與硫酸反應:BaCl2+H2SO4=BaSO4↓+ 2HCl 硝酸銀能與鹽酸反應: AgNO3+HCl=HNO3+AgCl↓
常見的堿
堿的定義:物質溶于水時,形成的陽離子全部是OH-的化合物。
氫氧化鈉和氫氧化鈣
堿 氫氧化鈉(燒堿、火堿、苛性鈉) 氫氧化鈣(消石灰、熟石灰)
化學式 NaOH Ca(OH)2
制法 Na2CO3+Ca(OH)2=2NaOH+CaCO3↓ CaO+H2O=Ca(OH)2
狀態 白色塊狀固體 白色粉末狀固體
腐蝕性 強腐蝕性 如果不慎將氫氧化鈉溶液沾到皮膚上,先用大量水沖洗,再涂上硼酸溶液。 較強腐蝕性
特點 易溶于水,時放出大量的熱。 氫氧化鈉固體易吸水而潮解。 微溶于水,溶于水時放熱不明顯。
鑒別 通入CO2,產生白色沉淀的為氫氧化鈣
用途 制取肥皂、石油、造紙、紡織和印染工業,氫氧化鈉能與油脂反應,所以可以除油污,實驗室做氣體的干燥劑。 做建筑材料、涂樹木上防凍傷和防蟲卵 改良酸性土壤和河流、配制波爾多液,在實驗室中檢驗二氧化碳。
堿的化學性質
堿有相同的化學性質是因為不同的堿溶液中都含有相同的OH-。
①+酸堿指示劑 堿溶液(四大強堿的溶液、氨水)能使指示劑變色: 使紫色石蕊溶液變藍,使無色酚酞溶液變紅。 由于弱堿不溶于水,所以弱堿不能使指示劑變色。
②+某些非金屬氧化物 2NaOH+CO2 = Na2CO3+H2O(吸收二氧化碳) 2NaOH+SO2 = Na2SO3+H2O(吸收二氧化硫) 2NaOH+SO3 = Na2SO4+H2O Ca(OH)2+CO2 = CaCO3↓+ H2O(檢驗二氧化碳)
③+酸 (復分解反應、中和反應) 6HCl+Fe(OH)3 = FeCl3+3H2O 現象:紅褐色固體消失,溶液變為黃色 2HCl+Cu(OH)2 = CuCl2+2H2O 現象:藍色固體消失,溶液變為藍色
④+鹽 (復分解反應) 反應發生的條件: A.反應物能溶于水(包括氫氧化鈣,不包括其他微溶于水的物質); B.新堿是氨水; C.若新堿不是氨水,新堿和新鹽中至少有一個沉淀。 D.銨鹽一定能與四大強堿反應。 新堿是沉淀: 藍色沉淀:2NaOH+CuSO4=Na2SO4+Cu(OH)2↓ 紅褐色沉淀:3NaOH+FeCl3=3NaCl+Fe(OH)3↓ 白色沉淀:2NaOH+MgSO4=Na2SO4+Mg(OH)2↓ 新鹽是沉淀: Ba(OH)2+Na2SO4=BaSO4↓+2NaOH Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 藍白沉淀:Ba(OH)2+CuSO4=BaSO4↓+ Cu(OH)2↓ 紅白沉淀:3Ba(OH)2+Fe2(SO4)3=3BaSO4↓+ 2Fe(OH)3↓ 波爾多液(注:波爾多液不是溶液):Ca(OH)2+CuSO4=CaSO4+Cu(OH)2↓
常用氣體干燥劑
干燥劑 濃硫酸(酸性) 氫氧化鈉(堿性) 氧化鈣(吸水后生成堿) 氯化鈣(中性)
堿石灰(氫氧化鈉、生石灰混合物)
裝置
可干燥的氣體 O2、H2、CO、SO2、HCl等 O2、H2、CO、NH3等 O2、H2、CO、CO2、HCl等
不可干燥的氣體 NH3 CO2、SO2、HCl等 NH3
溶液的酸堿度及表示
1.溶液的酸堿度即表示溶液酸性或堿性強弱的程度,常用pH來表示。
(1)pH的取值范圍通常在0~14之間。
pH<7,溶液呈酸性,pH數值越小酸性越強 pH=7,溶液呈中性 pH>7,溶液呈堿性,pH數值越大堿性越強
(2)pH的測定方法
在白瓷板或玻璃片上放一片pH試紙,用玻璃棒蘸取被測液滴到pH試紙上,把試紙呈現的顏色與標準比色卡比較,即可得到被測液的pH。用pH試紙測出的pH一般記整數,為粗略讀數。
①pH試紙不能用水潤濕,否則測酸性溶液的pH時所測值偏大,測堿性溶液的pH時所測值偏小。
②測溶液酸堿度時,pH試紙不能直接伸入待測液,會污染藥品。
(3)溶液酸堿度的應用
①pH小于5.6的雨水為酸雨。
②很多化工反應必須在一定pH的溶液中才能進行。
③廁所清潔劑顯強酸性,除水垢;爐具清潔劑顯強堿性,除酸性的油污;草木灰顯堿性,改良酸性土壤
酸、堿溶液的稀釋過程中pH的變化曲線
酸溶液中加水 堿溶液中加水 堿溶液中加酸 酸溶液中加堿
酸和堿的中和反應
中和反應:酸和堿作用生成鹽和水的反應,叫做中和反應。
中和反應實質:H+ + OH –=H2O(放熱)
中和反應的應用
改變土壤的酸堿性
用熟石灰改良酸性土壤;用碳酸水改良堿性土壤。
處理工廠污水
用熟石灰中和硫酸廠的廢水:H2SO4+Ca(OH)2 = CaSO4+2H2O
用硫酸中和含氫氧化鈉的廢水:H2SO4+2NaOH = Na2SO4+2H2O
醫藥和日常生活
用氫氧化鎂或氫氧化鋁治療胃酸過多:
3HCl+Al(OH)3 = AlCl3+3H2O ; 2HCl+Mg(OH)3 = MgCl2+2H2O
用堿性物質如稀氨水、肥皂水治療蚊蟲叮咬,減少痛癢。
展開更多......
收起↑
 資源預覽
資源預覽